Différence entre la liaison arrière et la liaison des coordonnées
Le différence clé entre la liaison arrière et la liaison coordonnée est que La liaison arrière fait référence à une liaison chimique qui se forme entre une orbitale atomique d'un atome et une orbitale antibondante d'un ligand tandis que la liaison coordonnée se réfère au partage d'une paire d'électrons entre une espèce électronégative et une espèce électro-déficiente.
Les liaisons de coordonnées se produisent généralement dans des complexes de coordination dans lesquels un atome métallique central est entouré d'un ensemble de ligands, qui sont liés à l'atome métallique par des liaisons coordonnées. Ici, les ligands partagent leurs paires d'électrons solitaires avec l'atome métallique. Mais, dans la liaison arrière, une liaison chimique se forme entre une orbitale atomique d'un atome et une orbitale antibondante d'un autre atome lorsqu'ils ont des symétries équivalentes. En chimie organométallique, ce type de liaisons chimiques est courante.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le lien de retour
3. Qu'est-ce que la liaison coordonnée
4. Comparaison côte à côte - liaison arrière vs liaison des coordonnées sous forme tabulaire
5. Résumé
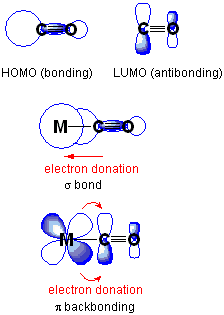
Qu'est-ce que le lien de retour?
La liaison arrière ou la liaison PI-Back est une situation où les électrons d'une orbitale atomique d'un atome se déplacent vers une orbitale anti-un autre atome, formant une liaison chimique. Ici, les deux formes d'orbitales devraient avoir une symétrie appropriée. Habituellement, l'atome avec l'orbitale atomique est un métal de transition tandis que l'atome avec l'orbite antibondante fait partie d'un ligand de pi-accepteur. Dans la chimie organométallique, ce type de liaison chimique est courant, et il a des métaux de transition complexés avec des ligands multiatiques, E.g., monoxyde de carbone, éthylène, ion nitrosonium.

Figure 01: Don de dos
De plus, la liaison du dos est un processus synergique. Il implique le don d'électrons d'une orbitale remplie d'électrons ou contenant une paire d'électrons solitaires dans une orbitale vide du métal de transition, ainsi que la libération d'électrons d'une orbitale D du métal dans une orbitale anti-unclacable du ligand.
Qu'est-ce que la liaison coordonnée?
La liaison coordonnée se réfère à une liaison covalente dans laquelle les électrons de liaison partagés sont fournis par l'un des deux atomes de la liaison. Cela signifie; Un atome donne l'une de ses paires d'électrons solitaires à un autre atome, et la paire d'électrons solitaires est partagée entre les deux atoms par la suite. Puisqu'il s'agit d'un don, nous pouvons également le nommer comme une liaison dative ou une liaison dipolaire.
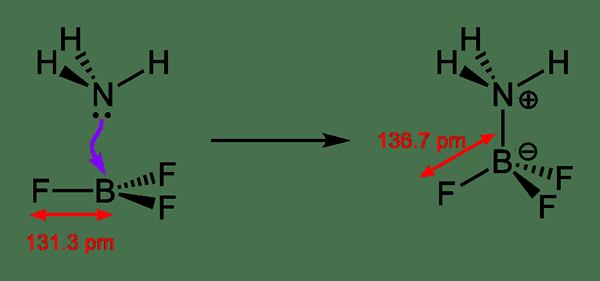
Figure 02: un processus de formation de liaisons dative
Lors du dessin des structures chimiques, nous pouvons montrer la liaison coordonnée à l'aide d'une flèche; La pointe de flèche montre quel atome a accepté les électrons et la queue de flèche commence à partir de l'atome qui a donné la paire d'électrons. Cependant, il s'agit également d'un type de liaison covalente; Par conséquent, nous remplaçons cette flèche par une ligne habituelle pour montrer qu'il s'agit d'une liaison où une paire d'électrons est partagée. Ces liaisons se trouvent couramment dans les complexes de coordination où un ion métallique accepte les paires d'électrons solitaires des ligands.
Quelle est la différence entre la liaison arrière et la liaison des coordonnées?
Le liaison arrière et la liaison des coordonnées sont deux liaisons covalentes différentes. La principale différence entre la liaison du dos et la liaison coordonnée est que la liaison du dos se réfère à la liaison chimique qui se forme entre une orbitale atomique d'un atome et une orbitale antibondante d'un ligand tandis que la liaison coordonnée se réfère au partage d'une paire d'électrons entre une espèce électronégative et une espèce électro-déficiente.
Ci-dessous les mémoires infographiques la différence entre la liaison arrière et la liaison coordonnée.
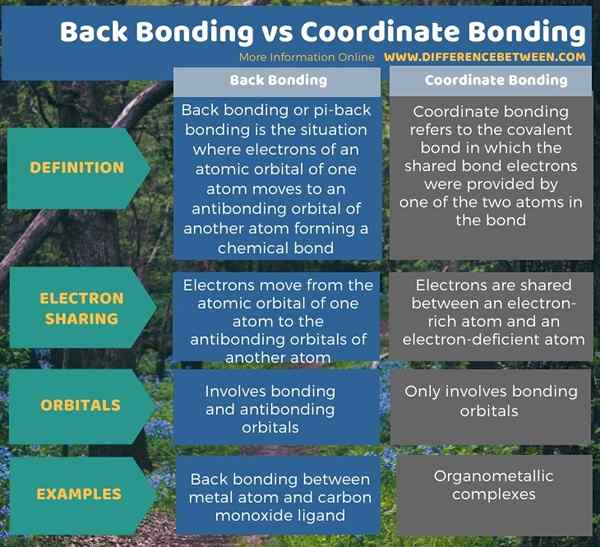
Résumé - Boullage du dos vs collage des coordonnées
Le liaison arrière et la liaison des coordonnées sont deux formes différentes de liaisons covalentes. La principale différence entre la liaison du dos et la liaison coordonnée est que la liaison du dos se réfère à la liaison chimique qui se forme entre une orbitale atomique d'un atome et une orbitale antibondante d'un ligand tandis que la liaison coordonnée se réfère au partage d'une paire d'électrons entre une espèce électronégative et une espèce électro-déficiente.
Référence:
1. Helmenstine, Anne Marie. «Définition des obligations datives (obligation coordonnée).”Thoughtco, oct. 14, 2019, disponible ici.
Image gracieuseté:
1. «Bondage de dos» par OMCV - propre travail (domaine public) via Commons Wikimedia
2. «NH3-BF3-adduct-lingening-2d» par Ben Mills - propre travail (domaine public) via Commons Wikimedia


