Différence entre le poids atomique et le nombre de masse
Le différence clé entre le poids atomique et le nombre de masse est que Le poids atomique est la masse moyenne calculée compte tenu de tous les isotopes tandis que le nombre de masse est la masse d'un isotope spécifique.
Nous pouvons caractériser les atomes par leurs nombres atomiques et leurs nombres de masse. Dans le tableau périodique, les atomes sont organisés en fonction de leur numéro atomique. Le nombre de masse d'un élément est lié à sa masse. Cependant, il ne donne pas la masse exacte de l'atome. Le poids atomique est une autre façon d'exprimer le poids des atomes, mais cela est différent de la masse atomique. Cependant, il est important d'identifier la signification de ces terminologies séparément, car ils peuvent faire de grandes différences dans les mesures si nous les utilisons de manière interchangeable.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le poids atomique
3. Qu'est-ce que le numéro de masse
4. Comparaison côte à côte - poids atomique vs nombre de masse sous forme tabulaire
5. Résumé
Qu'est-ce que le poids atomique?
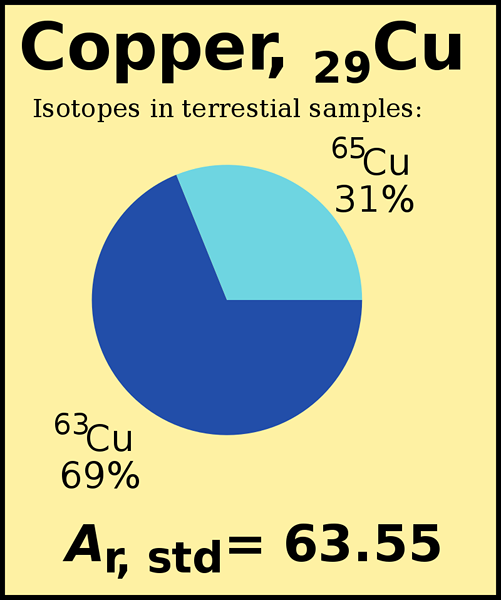
Les atomes contiennent principalement des protons, des neutrons et des électrons. La masse atomique est simplement la masse d'un atome. La plupart des atomes du tableau périodique ont deux isotopes ou plus. Les isotopes diffèrent les uns des autres en ayant un nombre différent de neutrons même s'ils ont la même quantité de protons et d'électrons. Étant donné que leur quantité de neutrons est différente, chaque isotope a une masse atomique différente. Le poids atomique est le poids moyen que nous calculons compte tenu de toutes les masses d'isotopes. Chaque isotope est présent dans l'environnement, en différents pourcentages. Lors du calcul du poids atomique, nous devons considérer à la fois la masse isotopique et leurs abondances relatives.

Figure 01: Poids atomique standard du cuivre
De plus, les masses d'atomes sont extrêmement petites, nous ne pouvons donc pas les exprimer dans des unités de masse normales comme les grammes ou les kilogrammes. Les poids indiqués dans le tableau périodique sont calculés comme ci-dessus et sont donnés comme masse atomique relative.
Cependant, la définition de l'IUPAC du poids atomique est la suivante:
«Un poids atomique (masse atomique relative) d'un élément d'une source spécifiée est le rapport de la masse moyenne par atome de l'élément à 1/12 de la masse d'un atome de 12C."
La masse de l'isotope le plus abondant contribue davantage au poids atomique. Par exemple, l'abondance naturelle de CL-35 est de 75.76%, tandis que l'abondance de CL-37 est de 24.24%. Le poids atomique du chlore est de 35.453 (AMU), qui est plus proche de la masse de l'isotope CL-35.
Qu'est-ce que le numéro de masse?
Le nombre de masse est le nombre total de neutrons et de protons dans le noyau d'un atome. Nous appelons généralement la collection de neutrons et de protons comme des nucléons. Par conséquent, nous pouvons également définir le nombre de masse comme le nombre de nucléons dans le noyau d'un atome.
Normalement, nous désignons cette valeur dans le coin supérieur gauche de l'élément (comme exposant) comme une valeur entière. Différents isotopes ont des nombres de masse différents car leurs neutrons varient. Ainsi, le nombre de masse d'un élément donne la masse de l'élément dans les entiers. La différence entre le nombre de masse et le nombre atomique d'un élément donne le nombre de ses neutrons.
Quelle est la différence entre le poids atomique et le nombre de masse?
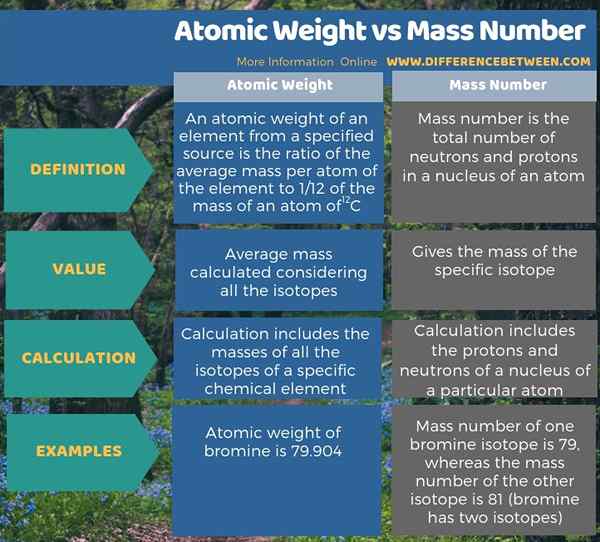
La principale différence entre le poids atomique et le nombre de masse est que le poids atomique est la masse moyenne calculée compte tenu de tous les isotopes tandis que le nombre de masse donne la masse de l'isotope spécifique. La plupart du temps, le nombre de masse est considérablement différent du poids atomique. Par exemple, le brome a deux isotopes. Le nombre de masse d'un isotope est de 79, tandis que le nombre de masse de l'autre isotope est 81. De plus, le poids atomique du brome est de 79.904, qui est différent des deux masses isotopiques.
Résumé - poids atomique vs nombre de masse
Le poids atomique et le nombre de masse sont deux concepts différents en chimie. La principale différence entre le poids atomique et le nombre de masse est que le poids atomique est la masse moyenne calculée compte tenu de tous les isotopes tandis que le nombre de masse donne la masse de l'isotope spécifique.
Référence:
1. Helmenstine, Anne Marie. «Définition de masse atomique: poids atomique."Thoughtco, Jan. 22, 2019, disponible ici.
Image gracieuseté:
1. «CIAAW 2013 - poids atomique standard pour Cupper (29, Cu)» par DePiep - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


