Différence entre l'unité de masse atomique et la masse atomique
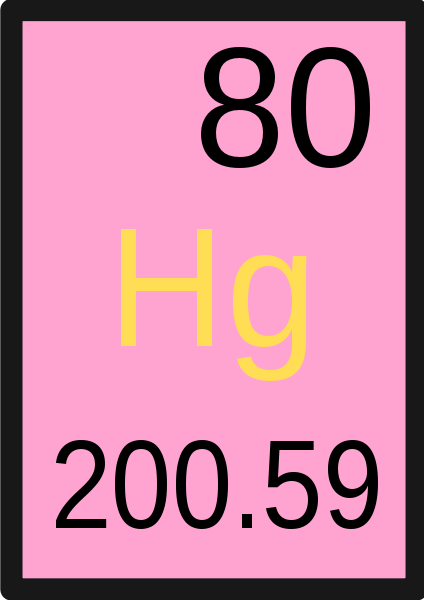
Le différence clé entre l'unité de masse atomique et la masse atomique est que le L'unité de masse atomique est l'unité que nous utilisons pour mesurer la masse d'un atome alors que la masse atomique est la masse d'un seul atome particulier.
Exprimer le poids des atomes ou des molécules était un problème pour les scientifiques aux premiers stades. Étant donné que les atomes sont extrêmement petits, nous ne pouvons pas mesurer leurs masses en utilisant des unités régulières comme des kilogrammes ou des grammes ou même en microgrammes. Par conséquent, les scientifiques ont proposé un nouveau concept pour mesurer ces.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'unité de masse atomique
3. Qu'est-ce que la masse atomique
4. Comparaison côte à côte - unité de masse atomique vs masse atomique sous forme tabulaire
5. Résumé
Qu'est-ce que l'unité de masse atomique?
Les masses d'atomes sont extrêmement petites. Ainsi, nous ne pouvons pas les exprimer dans des unités de masse normales comme les grammes ou les kilogrammes. Par conséquent, nous devons utiliser une autre unité appelée unité de masse atomique (AMU) pour mesurer la masse atomique. Une unité de masse atomique est un douzième de la masse d'un isotope C-12, qui est 1.66 x 10−27 kg. Lorsque nous divisons la masse d'un atome par un douzième de la masse d'un isotope C-12, nous pouvons obtenir sa masse relative. Et, cette valeur est un petit nombre, qui est facile à utiliser dans les calculs et à d'autres fins. Cependant, en général, lorsque nous disons la masse atomique relative d'un élément, nous entendons leur poids atomique (parce que nous le calculons compte tenu de tous les isotopes).
Avant d'utiliser le carbone-12 comme norme pour mesurer l'unité de masse atomique, les gens ont utilisé d'autres éléments. Par exemple, H-1 a été utilisé en premier. Plus tard, ils ont changé cela afin de réduire les erreurs. Après cela, ils ont utilisé des éléments avec des masses plus élevées. La norme suivante était l'oxygène-16. Plus tard, avec la découverte de la présence d'isotopes d'oxygène et d'autres problèmes qui y sont liés, l'unité de masse atomique a été mesurée par rapport à l'isotope en carbone-12.
Qu'est-ce que la masse atomique?
Les atomes contiennent principalement des protons, des neutrons et des électrons. La masse atomique est simplement la masse d'un atome. En d'autres termes, c'est la collection de masses de tous les neutrons, protons et électrons dans un seul atome, en particulier, lorsque l'atome ne se déplace pas (masse de repos). Nous devons prendre la masse de repos parce que, selon les fondamentaux de la physique, lorsque les atomes se déplacent à très grande vitesse, les masses augmentent.
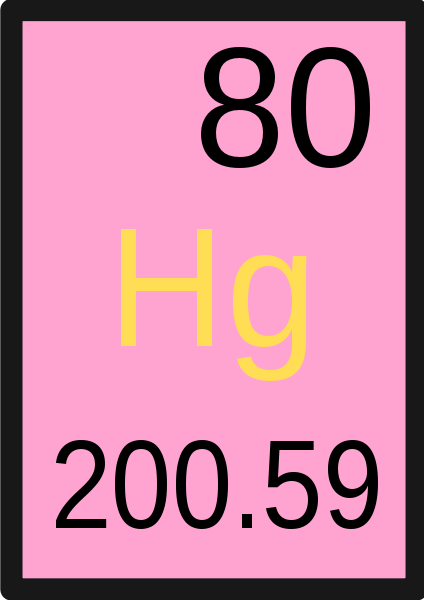
Figure 01: La masse atomique de mercure est de 200.59 amu
Cependant, la masse d'électrons est considérablement faible par rapport aux masses de protons et de neutrons. Par conséquent, nous pouvons dire que la contribution d'un électron à la masse atomique est moindre. La plupart des atomes du tableau périodique ont deux isotopes ou plus. Les isotopes diffèrent les uns des autres en ayant un nombre différent de neutrons, même s'ils ont la même quantité de proton et d'électrons. Étant donné que leur quantité de neutrons est différente, chaque isotope a une masse atomique différente. La moyenne de toute la masse isotopique est le poids atomique. Par conséquent, la masse d'un isotope spécifique est la masse atomique dans un atome, qui a plusieurs isotopes.
Quelle est la différence entre l'unité de masse atomique et la masse atomique?
La masse atomique est la masse d'un atome spécifique (sans prendre la masse moyenne des isotopes). L'unité de masse atomique est le 1/12 de la masse d'isotope de carbone -12. Par conséquent, la principale différence entre l'unité de masse atomique et la masse atomique est que l'unité de masse atomique est l'unité que nous utilisons pour mesurer la masse d'un atome alors que la masse atomique est la masse d'un seul atome particulier. De plus, nous pouvons utiliser l'unité de masse atomique pour indiquer les masses relatives d'autres atomes par rapport à la masse C-12.
L'infographie ci-dessous sur la différence entre l'unité de masse atomique et la masse atomique résume toutes ces différences.
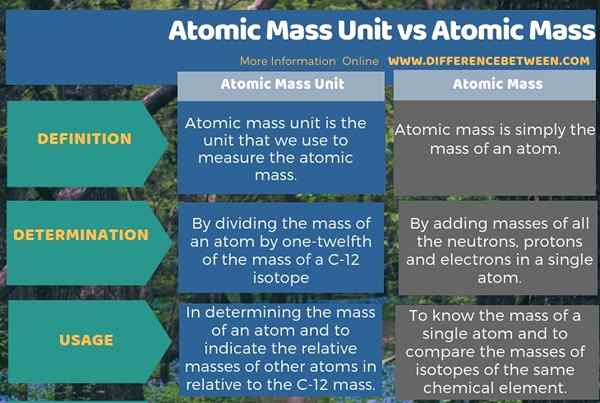
Résumé - Unité de masse atomique vs masse atomique
L'unité de masse atomique est l'unité de mesure de la masse atomique d'un seul atome. La principale différence entre l'unité de masse atomique et la masse atomique est que l'unité de masse atomique est l'unité que nous utilisons pour mesurer la masse d'un atome alors que la masse atomique est la masse d'un seul atome particulier.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Masse atomique et numéro de masse atomique (revue rapide).”Thoughtco, Jun. 13, 2018. Disponible ici
Image gracieuseté:
1.«Mercury (élément)» par moi (CC By-Sa 2.5) Via Commons Wikimedia


