Différence entre masse atomique et masse atomique moyenne
Le différence clé entre la masse atomique et la masse atomique moyenne est que le La masse atomique est la masse d'un atome, tandis que la masse atomique moyenne est la masse d'un atome d'un élément chimique particulier calculé en considérant les isotopes de cet élément.
Nous utilisons souvent les termes masse atomique et masse atomique moyenne interchangeable; Cependant, ce sont deux termes différents.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la masse atomique
3. Qu'est-ce que la masse atomique moyenne
4. Comparaison côte à côte - masse atomique vs masse atomique moyenne sous forme tabulaire
5. Résumé
Qu'est-ce que la masse atomique?
La masse atomique est la masse totale des nucléons présents dans le noyau d'un atome. Un nucléon est soit un p7p ou un neutron. Par conséquent, la masse atomique est la masse totale des protons et des neutrons présents dans le noyau. Bien que les électrons soient également présents dans les atomes, la masse d'électrons n'est pas utilisée dans les calculs car les électrons sont si petits et ont une masse négligeable par rapport aux protons et aux neutrons.
Contrairement à la masse atomique relative, nous calculons ici la masse de chaque atome sans calculer aucune valeur moyenne. Par conséquent, nous obtenons des valeurs différentes pour les masses atomiques de différents isotopes. C'est parce que le nombre de nucléons présents dans les isotopes du même élément est différent les uns des autres.

Analysons un exemple:
La masse atomique de l'hydrogène = 2
Ainsi, la masse atomique de l'isotope hydrogène-2 (deutérium) est calculée comme suit.
Le nombre de protons dans le noyau = 1
Le nombre de neutrons dans le noyau = 1
Par conséquent, la masse atomique de l'hydrogène = (1 amu + 1 amu) = 2 amu
Ici, la masse atomique est donnée par l'unité AMU (unités de masse atomique). Un proton ou un neutron a une masse de 1 amu.
Qu'est-ce que la masse atomique moyenne?
La masse atomique moyenne est la masse d'un atome d'un élément chimique particulier calculé en considérant les isotopes de cet élément. En cela, la valeur de masse dépend de l'abondance naturelle d'un élément chimique.
Il y a deux étapes pour calculer la masse atomique moyenne.
- Multipliez la masse atomique de chaque isotope de l'abondance naturelle (en prenant l'abondance en pourcentage) séparément.
- Ajoutez les valeurs obtenues ensemble pour obtenir la masse atomique moyenne.
Analysons un exemple:
Il y a deux isotopes de carbone comme carbone-12 et carbone-13. Leur abondance est respectivement de 98% et 2. Ensuite, nous pouvons déterminer la masse atomique moyenne de carbone en utilisant un calcul. Ici, nous devons multiplier les masses atomiques de chaque isotope avec la valeur d'abondance. Ensuite, nous devons prendre l'abondance en tant que valeur placée à deux décimales, et non en pourcentage. Ensuite, nous pouvons ajouter les valeurs obtenues.
Carbone-12: 0.98 * 12 = 11.76
Carbone-13: 0.02 * 13 = 0.26
Ensuite, la masse atomique moyenne de carbone est = 11.76 + 0.26 = 12.02 g / mol.
Quelle est la différence entre la masse atomique et la masse atomique moyenne?
Bien que le terme masse atomique et la masse atomique moyenne sonne, ce sont deux termes différents. La principale différence entre la masse atomique et la masse atomique moyenne est que la masse atomique est la masse d'un atome, tandis que la masse atomique moyenne est la masse d'un atome d'un élément chimique particulier calculé en considérant les isotopes de cet élément. Le terme masse atomique se réfère à la masse d'un seul atome tandis que le terme masse atomique moyenne se réfère à une masse d'un élément chimique.
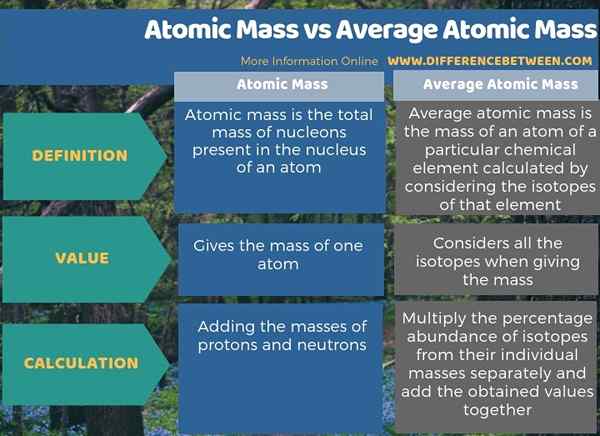
Résumé - Masse atomique vs masse atomique moyenne
La masse atomique se réfère à la masse d'un seul atome, mais la masse atomique moyenne se réfère à la masse moyenne d'un atome d'un élément chimique particulier. Par conséquent, la principale différence entre la masse atomique et la masse atomique moyenne est que la masse atomique est la masse d'un atome, tandis que la masse atomique moyenne est la masse d'un atome d'un élément chimique particulier calculé en considérant les isotopes de cet élément.
Référence:
Helmenstine, Anne Marie. «Comment calculer la masse atomique."Thoughtco, août. 21, 2019, disponible ici.
Helmenstine, Anne Marie. «Comment calculer la masse atomique."Thoughtco, août. 21, 2019, disponible ici.
Image gracieuseté:
1. «Atome stylisé avec trois orbites de modèle Bohr et noyau stylisé» par SVG par Indolences. Recolorer et repasser quelques problèmes réalisés par Rainer Klute. - Propre travail basé sur: de l'image: atome de lithium stylisé.png par halfan (cc by-sa 3.0) via Commons Wikimedia


