Différence entre amphiprotique et polyprotique
Le différence clé entre amphiprotique et polyprotique est que L'amphiprotique fait référence à la capacité de faire un don et d'accepter des protons, tandis que Polyprotic fait référence à la capacité de donner ou d'accepter plus d'un proton.
Les termes amphiprotiques et polyprotiques sont utilisés comme adjectifs pour décrire les composés chimiques. Ces termes décrivent la capacité ou l'incapacité à donner / accepter les protons. En ces termes, «-protic» signifie des protons, qui sont les H+ ions qui peuvent être retirés d'un composé chimique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'amphiprotique
3. Qu'est-ce que le polyprotique
4. Comparaison côte à côte - amphiprotique vs polyprotique sous forme tabulaire
5. Résumé
Qu'est-ce que l'amphiprotique?
L'amphiprotique fait référence à la capacité d'un composé chimique à faire un don ou à accepter des protons. Plus précisément, les composés chimiques amphiprotiques sont en mesure de faire un don et d'accepter des protons à ou depuis d'autres composés. Dans ce contexte, nous nous référons à H+ ions comme protons. Les composés amphiprotiques peuvent être un acide ou une base. Par conséquent, ces composés ont des caractéristiques acides et de base.

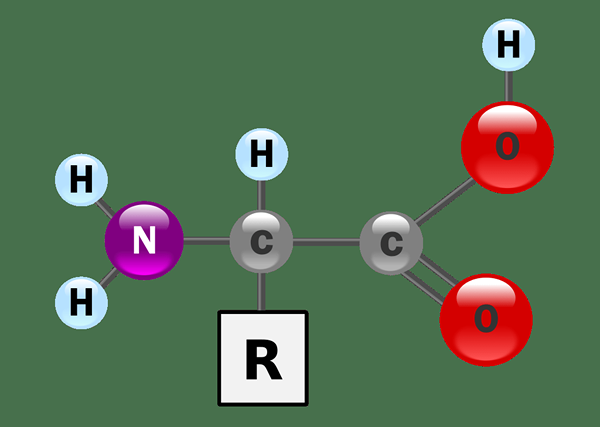
Figure 01: Les acides aminés sont amphiprotiques
Les exemples de composés chimiques amphiprotiques comprennent les acides aminés, qui contient des groupes amine et des groupes carboxyliques, des protéines composées d'acides aminés, et de l'eau, qui contient des protons et des paires d'électrons solitaires sur l'atome d'oxygène qui peuvent agir comme accepteur de proton.
Qu'est-ce que le polyprotique?
Polyprotic fait référence à la capacité d'un composé chimique à donner plus d'un proton. Ici, «Poly» signifie beaucoup et «-protic» signifie un don de protons. Il existe deux types d'espèces chimiques polyprotiques comme acides polyprotiques et bases polyprotiques.
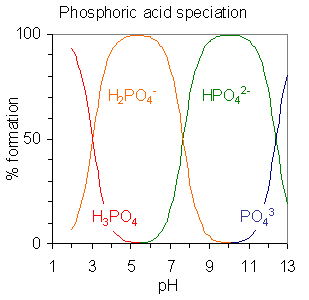
Figure 02: L'acide phosphorique est un acide polyprotique. Il a trois protons amovibles.
Les acides polyprotiques sont capables de libérer plus d'un proton par molécule. Les bases polyprotiques sont des espèces chimiques capables d'accepter plus d'un proton par molécule. Par exemple, l'acide sulfurique, l'acide phosphorique, l'acide carbonique, l'acide sulfureux, etc. sont des acides polyprotiques. Ion phosphate, ion sulfate, ion carbonate, etc. sont des exemples de bases polyprotiques.
Quelle est la différence entre amphiprotique et polyprotique?
Les termes amphiprotiques et polyprotiques se réfèrent à l'élimination des protons des composés chimiques. La principale différence entre l'amphiprotique et le polyprotique est que l'amphiprotique fait référence à la capacité de donner et d'accepter les protons, tandis que le polyprotique fait référence à la capacité de donner ou d'accepter plus d'un proton.
De plus, les espèces chimiques amphiprotiques peuvent donner ou accepter un ou plusieurs protons par molécule tandis que les espèces chimiques polyprotiques peuvent donner ou accepter plus d'un proton par molécule. Certains exemples de composés chimiques amphiprotiques comprennent les acides aminés, les protéines et l'eau, tandis que les exemples d'espèces chimiques polyprotiques comprennent l'acide phosphorique, l'acide sulfureux, l'acide sulfurique et l'ion phosphate.
Le tableau suivant résume la différence entre les espèces chimiques amphiprotiques et polyprotiques.

Résumé - amphiprotique vs polyprotique
Les termes amphiprotiques et polyprotiques se réfèrent à l'élimination des protons des composés chimiques. La principale différence entre l'amphiprotique et le polyprotique est que l'amphiprotique fait référence à la capacité de faire un don et d'accepter des protons tandis que le polyprotique se réfère à la capacité de donner ou d'accepter plus d'un proton. Certains exemples de composés chimiques amphiprotiques comprennent les acides aminés, les protéines et l'eau tandis que certains exemples d'espèces chimiques polyprotiques comprennent l'acide phosphorique, l'acide sulfureux, l'acide sulfurique et l'ion phosphate.
Référence:
1. Helmenstine, Anne Marie. «Définition amphiprotique en chimie."Thoughtco, février. 11, 2020, disponible ici.
2. «11.11: espèces amphiprotiques.”Chemistry LibreTexts, LibreTexts, 7 février. 2020, disponible ici.
3. «Acides et bases polyprotiques.”Chemistry LibreTexts, LibreTexts, 5 juin 2019, disponible ici.
Image gracieuseté:
1. «Amino Acid Ball» de Gyassinemrabettalk✉ Cette image vectorielle non spécifiée W3C a été créée avec Inkscape. - Propre travail (domaine public) via Commons Wikimedia
2. «Phosphoric3» par Petergans (Talk) - un diagramme de distribution des espèces comme décrit dans la section 2.4, domaine public) via les communes Wikimedia


