Différence entre l'amine et l'acide aminé

Amine vs acide aminé
L'amine et les acides aminés sont des composés contenant de l'azote.
Amine
Les amines peuvent être considérées comme des dérivés organiques de l'ammoniac. Les amines ont une azote liée à un carbone. Les amines peuvent être classées comme amines primaires, secondaires et tertiaires. Cette classification est basée sur le nombre de groupes organiques qui sont attachés à l'atome d'azote. Par conséquent, l'amie primaire a un groupe R attaché à l'azote; Les amines secondaires ont deux groupes R et les amines tertiaires ont trois groupes R. Normalement, dans la nomenclature, les amines primaires sont nommées alkylamines. Il y a des aryl amines comme l'aniline, et il y a aussi des amines hétérocycliques. Les amines hétérocycliques importantes ont des noms communs comme le pyrrole, le pyrazole, l'imidazole, l'indole, etc. Les amines ont une forme bipyramidale trigonale autour de l'atome d'azote. L'angle de liaison C-N-C de triméthyl amine est 108.7, qui est proche de l'angle de liaison H-C-H du méthane. Ainsi, l'atome d'azote de l'amine est considéré comme SP3 hybridé. Ainsi, la paire d'électrons non partagée dans de l'azote est également dans un SP3 orbite hybridé. Cette paire d'électrons non partagée est principalement impliquée dans les réactions des amines. Les amines sont modérément polaires. Leurs points d'ébullition sont plus élevés que les alcanes correspondants en raison de la capacité de faire des interactions polaires. Cependant, leurs points d'ébullition sont inférieurs aux alcools correspondants. Les molécules d'amine primaires et secondaires peuvent former de fortes liaisons hydrogène les unes avec les autres et avec de l'eau, mais les molécules d'amine tertiaires ne peuvent former que des liaisons hydrogène à l'eau ou à tout autre solvants hydroxyliques (ne peuvent pas former des liaisons hydrogène entre eux). Par conséquent, les amines tertiaires ont un point d'ébullition plus faible que les molécules d'amine primaire ou secondaire. Les amines sont des bases relativement faibles. Bien qu'ils soient des bases plus fortes que l'eau, par rapport aux ions d'alcoxyde ou aux ions d'hydroxyde, ils sont beaucoup plus faibles. Lorsque les amines agissent comme des bases et réagissent avec les acides, ils forment des sels d'aminium, qui sont chargés positivement. Les amines peuvent également former des sels d'ammonium quaternaire lorsque l'azote est attaché à quatre groupes et ainsi de devenir chargé positivement.
Acide aminé
L'acide aminé est une molécule simple formée avec c, h, o, n et peut être s. Il a la structure générale suivante.
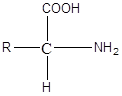
Il y a environ 20 acides aminés communs. Tous les acides aminés ont un -cooh, -nh2 des groupes et un -h se sont liés à un carbone. Le carbone est un carbone chiral, et les acides aminés alpha sont les plus importants dans le monde biologique. Les acides D-amino ne sont pas trouvés dans les protéines et ne font pas partie du métabolisme des organismes supérieurs. Cependant, plusieurs sont importants dans la structure et le métabolisme des formes de vie inférieures. En plus des acides aminés communs, il existe un certain nombre d'acides aminés non dérivés de protéines, dont beaucoup sont soit des intermédiaires métaboliques, soit des parties de biomolécules non protéiques (ornithine, citrulline). Le groupe R diffère de l'acide aminé à l'acide aminé. L'acide aminé le plus simple avec le groupe R étant H est la glycine. Selon le groupe R, les acides aminés peuvent être classés en aliphatiques, aromatiques, non polaires, polaires, chargés positivement, chargés négativement ou non chargés, etc. Acides aminés présents sous forme d'ions zwitter dans le pH physiologique 7.4. Les acides aminés sont les éléments constitutifs des protéines.
| Quelle est la différence entre Amine et acide aminé? • Les amines peuvent être primaires, secondaires ou tertiaires. Dans les acides aminés, le groupe d'amine primaire peut être vu. • Les acides aminés ont un groupe carboxylique qui lui donne des propriétés acides par rapport aux amines. |


