Différence entre l'aluminate et la méta-aluminate

Le différence clé entre l'aluminate et la méta-aluminate est que L'aluminate est un anion d'oxyde, tandis que la méta-aluminate est un anion hydroxyde.
L'aluminate et la méta-aluminate sont deux types d'anions qui sont liés les uns aux autres en fonction de leur structure chimique. Cependant, leur atomicité est différente les unes des autres. En effet.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'aluminé
3. Qu'est-ce que la méta-aluminate
4. Comparaison côte à côte - aluminate vs méta-aluminate sous forme tabulaire
5. Résumé
Qu'est-ce que l'aluminé?
L'aluminate est un oxyanion de l'aluminium ayant la formule chimique ALO4-. Le composé le plus courant contenant un anion en aluminate est l'aluminate de sodium. De plus, l'aluminate de sodium pur est un composé anhydre qui apparaît comme un solide cristallin blanc. Pendant ce temps, l'aluminate de sodium hydratée se produit sous forme de composé d'hydroxyde. Et, la forme en aluminate de sodium hydratée la plus courante est la tétrahydroxyalumiminate de sodium.

Figure 01: Aspect de l'aluminate de sodium
Moreoer, l'anion aluminate est un anion polyatomique contenant un atome d'aluminium au centre de l'anion et quatre atomes d'oxygène attachés à cet atome d'aluminium central via des liaisons covalentes. La charge de l'anion est -1. La masse molaire de l'anion est de 91 g / mol.
Qu'est-ce que la méta-aluminate?
Méta-aluminate est la forme hydratée de l'anion en aluminate. Par conséquent, l'aluminate est un oxyanion tandis que la méta-aluminate est un anion hydroxyde. La formule chimique de cet anion est Al (OH)4-. De plus, la masse molaire de cet anion est de 95 g / mol. De plus, un anion méta-aluminate se forme lorsque deux molécules d'eau s'associent avec un anion en aluminate.
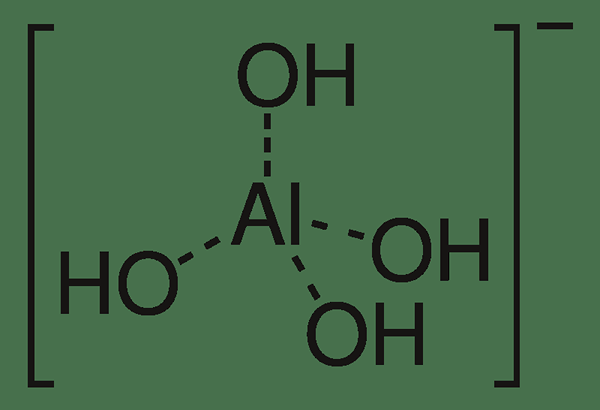
Figure 02: La structure chimique de l'anion en aluminate méta-alumin
Normalement, Alo2- ion est appelé «méta» tandis que l'alo33- ion est appelé le composé «ortho». Les conformations ortho, para et méta-méta des ions aluminate diffèrent les unes des autres en fonction du degré de condensation. Le terme «méta» fait référence à la forme la moins hydratée d'aluminate de sodium.
Quelle est la différence entre l'aluminate et la méta-aluminate?
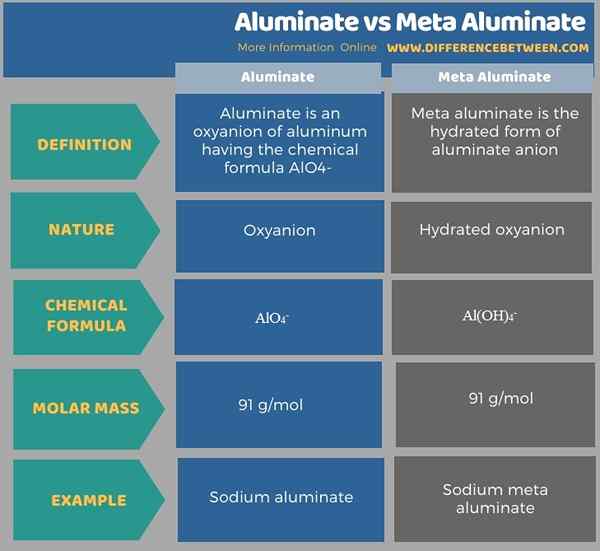
L'aluminate et la méta-aluminate sont deux formes anioniques apparentées. La principale différence entre l'aluminate et l'aluminate métallique est que l'aluminate est un anion d'oxyde, tandis que la méta-aluminate est un anion d'hydroxyde. De plus, la formule chimique de l'aluminate est allo4- tandis que la formule chimique de la méta-aluminate est Al (OH)4-.
De plus, l'anion en aluminate est un oxyanion tandis que la méta-aluminate est un oxyanion hydraté. Donc, c'est une autre différence entre l'aluminate et l'aluminate métallique. De plus, la masse molaire de l'aluminate est de 91 g / mol, tandis que la masse molaire de méta-aluminate est de 95 g / mol.
Selon la composition, nous pouvons appeler l'aluminate une oxyanion (contient des atomes d'aluminium et d'oxygène) tandis que les méta-aluminate peuvent être classées comme une hydroxyanion (contient de l'aluminium en combinaison avec des atomes d'oxygène et d'hydrogène). L'aluminate de sodium est un exemple bien connu d'un composé contenant un anion en aluminate tandis que la méta-aluminate de sodium est un exemple de composé contenant un anion méta-aluminate.
En dessous de l'infographie résume la différence entre l'aluminate et l'aluminate métallique.
Résumé - Aluminate vs méta-aluminate
L'aluminate et la méta-aluminate sont deux formes anioniques apparentées. La principale différence entre l'aluminate et l'aluminate métallique est que l'aluminate est un anion d'oxyde, tandis que la méta-aluminate est un anion d'hydroxyde. Par conséquent, l'aluminate est appelée oxyanion et la méta-aluminate est appelée hydroxyanion. La formule chimique de l'anion aluminate est allo4- tandis que la formule chimique de l'anion en aluminate méta-aluminaire est Al (OH)4-.
Référence:
1. «Aluminate.»Wikipedia, Wikimedia Foundation, 4 septembre. 2019, disponible ici.
2. «Aluminate.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici.
3. «Aluminate de sodium.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici.
Image gracieuseté:
1. «Naalo2» par Leiem - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Tetrahydroxoaluminate Ion» par Leyo - Propre travaux (domaine public) via Commons Wikimedia


