Différence entre l'allotrope et l'isomère
Différence clé - Allotrope vs isomère
Certains éléments du tableau périodique peuvent se produire dans différentes formules ou différents arrangements tout en étant stable à température ambiante. Ils peuvent être un composé composé d'un seul élément ou d'un composé composé de plusieurs éléments. Les allotropes et les isomères sont de bons exemples pour de tels éléments. La principale différence entre l'allotrope et l'isomère est que Les allotropes sont des composés avec les mêmes éléments mais une formule chimique différente dans des arrangements différents alors que Les isomères sont des composés ayant des éléments différents mais la même formule chimique dans des arrangements différents.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'un allotrope
3. Qu'est-ce qu'un isomère
4. Comparaison côte à côte - Allotrope vs isomère sous forme tabulaire
5. Résumé
Qu'est-ce qu'un allotrope?
Le mot allotrope peut être défini comme un type alternatif. En détail, il fait référence à différents types de composés fabriqués à partir du même élément unique mais dans différentes formules chimiques et différentes arrangements. Ces allotropes existent dans le même état physique dans les mêmes conditions (température ambiante) mais présentent des différences dans leurs propriétés physiques et chimiques. Différents allotropes peuvent être observés dans les métaux, les non-métaux et les métalloïdes.
Exemples d'allotropes
Allotropes de carbone
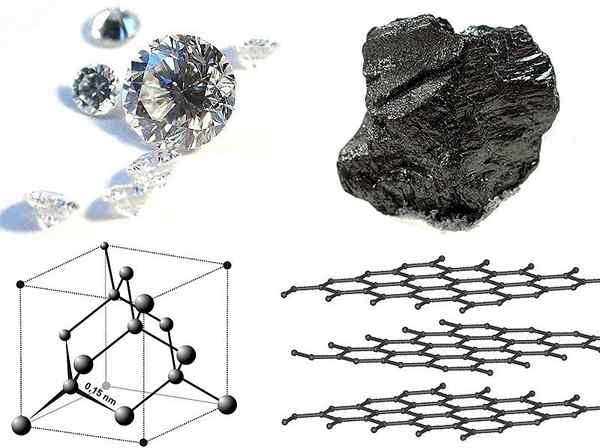
Les allotropes en carbone existent à l'état solide. Les types les plus courants sont le diamant, le graphite et le noir de carbone. Ici, il n'est pas si facile de changer un type d'allotrope en une autre structure d'allotrope. Le diamant est une structure extrêmement dure alors que le graphite n'est pas si difficile. Le noir de carbone existe sous forme de poudre.

Figure 01: Structure et apparence du diamant (à gauche) et du graphite (à droite)
Allotropes d'oxygène
Les types les plus courants d'allotropes d'oxygène qui se trouvent naturellement sont l'oxygène diatomique (o2), et ozone (o3). La différence entre eux est que l'oxygène a deux atomes d'oxygène liés à une double liaison tandis que l'ozone est composé de trois atomes d'oxygène qui existent comme structure de résonance.
Allotropes de soufre
Les allotropes de soufre sont différents les uns des autres en fonction du nombre d'atomes de soufre attachés et de leur arrangement. Dans le cas du soufre, il est quelque peu facile de changer une forme de soufre en un autre.
Qu'est-ce qu'un isomère?
Les isomères sont des composés ayant la même formule chimique mais des arrangements différents. Les isomères ont le même nombre et les types d'atomes, mais ces atomes sont disposés de différentes manières. Par conséquent, la structure chimique des isomères est différente les unes des autres. Les isomères sont divisés en deux grandes catégories appelées isomères structurels et stéréoisomères.
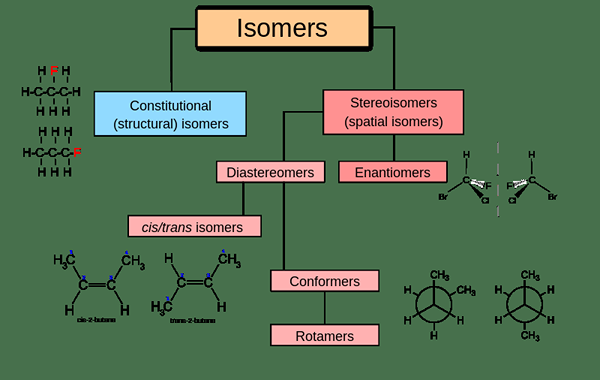
Figure 02: Classification des isomères
Isomères structurels
Dans ce type, les atomes et les groupes fonctionnels sont attachés de différentes manières pour faire la structure. Ce type comprend l'isomérisme de la chaîne, l'isomérisme de position et l'isomérisme de groupe fonctionnel.
Stéréoisomères
La structure de la liaison et la position des groupes fonctionnels sont les mêmes pour les isomères mais sont différents dans le positionnement géométrique. Les stéréoisomères incluent les isomères cis-trans (= diastéréomères) et les isomères optiques (= énantiomères).
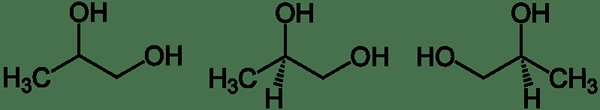
Figure 03: Stéréoisomères du propylène glycol (notez que la géométrie de l'atome H est différente en deux molécules).
Quelle est la différence entre l'allotrope et l'isomère?
Allotrope vs isomère | |
| Les allotropes sont des composés avec les mêmes éléments mais une formule chimique différente dans des arrangements différents. | Les isomères sont des composés ayant des éléments différents mais la même formule chimique dans des arrangements différents. |
| Nombre d'atomes | |
| Les allotropes sont composés de différents nombres d'atomes. | Les isomères ont le même nombre d'atomes. |
| Type d'éléments | |
| Les allotropes sont composés du même élément unique. | Les isomères sont composés de différents éléments. |
| Structure | |
| Les allotropes ont toujours des structures différentes. | Les isomères peuvent avoir des structures similaires ou différentes. |
| Présence | |
| Les allotropes peuvent être observés dans les métaux, les non-métaux et les métalloïdes | L'isomérisme peut être vu dans les molécules organiques (ex: hydrocarbures) et les molécules inorganiques (Ex: Silane). |
| Types majeurs | |
| Les types d'allotropes comprennent des allotropes en métal, des allotropes non métalliques et des allotropes métalloïdes | Les isomères comprennent principalement des isomères et des stéréoisomères structurels. |
Résumé - Allotropes vs isomères
Les allotropes et les isomères peuvent être définis comme des types alternatifs d'un élément ou d'un composé. La plupart du temps, ce sont des composés stables et naturellement trouvés. La principale différence entre l'allotrope et l'isomère est que les allotropes sont des composés avec les mêmes éléments dans différentes formules chimiques dans des arrangements différents tandis que les isomères sont des composés ayant des éléments différents avec la même formule chimique dans des arrangements différents.
Télécharger la version PDF des allotropes vs isomères
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon les notes de citation. Veuillez télécharger la version PDF ici différence entre Allotrope et isomère.
Référence:
1.Helmenstine, Anne Marie. «Qu'est-ce qu'un isomère? Passez en revue vos concepts de chimie."Thoughtco. N.p., n.d. la toile. Disponible ici. 01 juin 2017.
2.”Allotropes.”Chemistry LibreTexts. LibreTexts, 21 mars. 2017. Disponible ici. la toile. 01 juin 2017.
Image gracieuseté:
1. "Diamond et Graphite2" par Diamond_and_Graphite.JPG: Utilisateur: ITUBDERIVative Travail: MaterialScientist (Talk) - Diamond_and_graphite.jpgfile: graphite-tn19a.JPG (CC BY-SA 3.0) via Commons Wikimedia
2. «Isomérisme» par Vladsinger - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
3. «Stéréoisomères de propylène glycol V.1 ”par Jü - propre travail (domaine public) via Commons Wikimedia


