Différence entre les alcanes et les alcènes
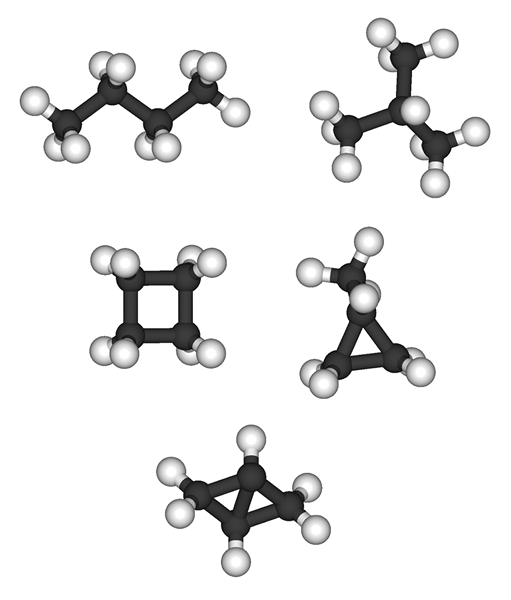
Différence clé - Alcanes vs alcènes
Les alcanes et les alcènes sont deux types de familles d'hydrocarbures qui contiennent du carbone et de l'hydrogène dans leur structure moléculaire. La principale différence entre les alcanes et les alcènes est leur structure chimique; Les alcanes sont des hydrocarbures saturés avec la formule moléculaire générale de CnH2n + 2 et les alcènes seraient un groupe d'hydrocarbures insaturés car ils contiennent une double liaison entre deux atomes de carbone. Ils ont la formule moléculaire générale de CnH2n.
Que sont les alcanes?
Les alcanes ne contiennent que des liaisons uniques entre les atomes de carbone et d'hydrogène (liaisons C-C et liaisons C-H). Par conséquent, ils sont appelés «hydrocarbures saturés». Selon le modèle d'hybridation orbitale, tous les atomes de carbone dans les alcènes ont le SP3 hybridation. Ils forment des liaisons sigma avec des atomes d'hydrogène, et la molécule résultante a la géométrie d'un tétraèdre. Les alcanes peuvent être subdivisés en deux groupes en fonction de leurs arrangements moléculaires; alcanes acycliques (cnH2n.+2) et les alcanes cycliques (cnH2n).
Que sont les alcènes?
Les alcènes sont les hydrocarbures, contenant une double liaison en carbone (C = C). «Oléfines» L'ancien nom est-il utilisé pour se référer à la famille alcène. Le plus petit membre de cette famille est l'éthane (C2H4)); ça s'appelait oléfiant Gas (en latin: 'oleum ' signifie «huile» + 'facere' signifie «faire») au début. C'est parce que la réaction entre C2H4 et le chlore donne c2H2CL2, huile.
Quelle est la différence entre les alcanes et les alcènes?
Structure chimique des alcanes et des alcènes
Alcanes: Les alcanes ont la formule moléculaire générale CnH2n + 2. Méthane (ch4) est le plus petit alcane.
| Nom | Formule chimique | Structure acyclique |
| Méthane | Ch4 | Ch4 |
| Éthane | C2H6 | Ch3Ch3 |
| Propane | C3H8 | Ch3Ch2Ch3 |
| Butane | C4Hdix | Ch3Ch2Ch2Ch3 |
| Pentane | C5H12 | Ch3Ch2Ch2Ch2Ch3 |
| Hexane | C6H14 | Ch3Ch2Ch2 Ch2Ch2Ch3 |
| Heptane | C7H16 | Ch3Ch2Ch2Ch2Ch2Ch2Ch3 |
| Octane | C8H18 | Ch3 Ch3Ch2Ch2Ch2Ch2Ch3Ch3 |
Alcènes: Les alcènes ont la formule chimique générale de CnH2n. Les alcènes sont considérés comme des hydrocarbures insaturés car ils ne contiennent pas le nombre maximal d'atomes d'hydrogène qui peuvent appartenir à une molécule d'hydrocarbure.
| Nom | Formule chimique | Structure |
| Éthène | C2H4 | Ch2 = Ch2 |
| Propene | C3H6 | Ch3Ch = ch2 |
| Butene | C4H8 | Ch2 =Chch2Ch3, Ch3Ch = chch3 |
| Pentène | C5Hdix | Ch2 =Chch2Ch2Ch3, Ch3Ch = chch2Ch3 |
| Hexène | C6H12 | Ch2 =Chch2 Ch2Ch2Ch3Ch3Ch = chch2Ch2Ch3 Ch3Ch2Ch=Chch2Ch3 |
| Heptène | C7H14 | Ch=Chch2Ch2Ch2Ch2Ch3Ch3Ch = ch2Ch2Ch2Ch2Ch3 |
Propriétés chimiques des alcanes et des alcènes
Alcanes:
Réactivité:
Les alcanes sont inertes pour de nombreux réactifs chimiques. En effet. Par conséquent, il est très difficile de briser leurs liaisons, à moins qu'ils ne soient chauffés à des températures assez élevées.
La combustion:
Les alcanes peuvent facilement brûler dans l'air. La réaction entre les alcanes avec un excès d'oxygène est appelée «combustion». Dans cette réaction, les alcanes se convertissent en dioxyde de carbone (CO2) et de l'eau.
CnH2n + (n + n / 2) o2 → N CO2 + NH2O
C4Hdix + 13/2 o2 → 4 CO2 + 5h2O
Butane oxygène en carbone à l'eau de dioxyde
Les réactions de combustion sont des réactions exothermiques (elles dégagent de la chaleur). En conséquence, les alcanes sont utilisés comme source d'énergie.
Alcènes:
Réactivité:
Les alcènes réagissent avec l'hydrogène en présence d'un catalyseur métallique finement divisé pour former l'alcane correspondant. La vitesse de la réaction est très faible sans catalyseur.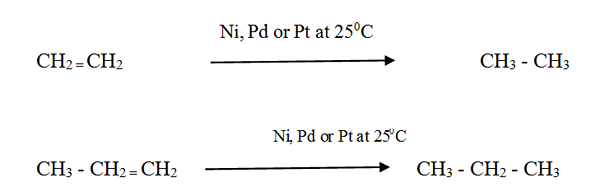
L'hydrogénation catalytique est utilisée dans l'industrie alimentaire pour convertir les huiles végétales liquides en graisses semi-solides pour fabriquer de la margarine et des graisses de cuisson solide.
Propriétés physiques des alcanes et des alcènes
Formes
Alcanes: Les alcanes existent sous forme de gaz, de liquides et de solides. Le méthane, l'éthane, le propane et le butane sont des gaz à température ambiante. Les structures non ramifiées de l'hexane, du pentane et de l'heptane sont des liquides. Les alcanes qui ont un poids moléculaire plus élevé sont des solides.
Ch4 à C4Hdix sont des gaz
C5H12 à C17H36 sont des liquides, et
Les alcanes avec un poids moléculaire plus élevé sont des solides mous
Alcènes: Les alcènes montrent des propriétés physiques similaires de l'alcane correspondant. Alcènes qui ont des poids moléculaires plus faibles (c2H4 toc4H8) sont des gaz à température ambiante et une pression atmosphérique. Les alcènes ayant un poids moléculaire plus élevé sont des solides.
Solubilité:
Alcanes: Les alcanes ne se dissolvent pas dans l'eau. Ils sont dissous dans des solvants organiques non polaires ou faiblement polaires.
Alcènes: Les alcènes sont des molécules relativement polaires en raison de la liaison C = C; Par conséquent, ils sont solubles dans des solvants non polaires ou des solvants de faible polarité. L'eau est une molécule polaire et les alcènes sont légèrement solubles dans l'eau.
Densité:
Alcanes: Les densités des alcanes sont inférieures à la densité de l'eau. Leur valeur de densité est de près de 0.7 g ML-1, Considérant la densité de l'eau comme 1.0 g ml-1.
Alcènes: Les densités des alcènes sont inférieures à la densité de l'eau.
Points d'ébullition:
Alcanes: Le point d'ébullition des alcanes non ramifiés augmente en douceur à mesure que le nombre d'atomes de carbone et le poids moléculaire augmentent. En général, les alcanes ramifiés ont des points d'ébullition inférieurs par rapport aux alcanes non ramifiés, ayant le même nombre d'atomes de carbone.
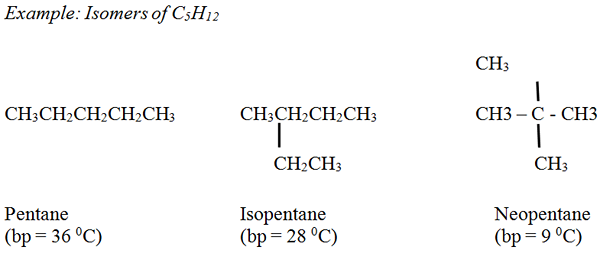
Alcènes: Les points d'ébullition sont similaires aux alcanes correspondants avec une petite variation.
Les références: Falaises. (n.d.). Récupéré le 06 juillet 2016, d'ici. Zum Directory-modus. (n.d.). Récupéré le 06 juillet 2016, d'ici Polarité. (n.d.). Récupéré le 06 juillet 2016, d'ici Moments dipolaires. (2013). Récupéré le 06 juillet 2016, d'ici Isomère structurel. (n.d.). Récupéré le 06 juillet 2016, d'ici Une introduction aux alcènes. (n.d.). Récupéré le 06 juillet 2016, d'ici Image gracieuseté: «Noms Alkene» de Chris Evans - (CC0) via Commons Wikimedia «Hydrocarbures C4 saturés Ball and-Stick» par FvasConcellos - Propre travaux (domaine public) via Commons Wikimedia

