Différence entre alcali et base

Le différence clé entre alcali et base est que le Les éléments du groupe 1 sont classés comme des éléments alcalins tandis que tout élément ou composé ayant des propriétés de base est classé comme une base.
Nous utilisons souvent le mot alcalin interchangeable pour aborder des solutions très basiques et des métaux alcalins. Dans ce contexte, Alcali est référé aux métaux alcalins du groupe 1 du tableau périodique des éléments. Cependant, le terme base peut faire référence à n'importe quel élément, molécule, ion, etc. qui ont des propriétés de base.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'alcali
3. Qu'est-ce que la base
4. Comparaison côte à côte - Base alcaline vs sous forme tabulaire
5. Résumé
Qu'est-ce que l'alcali?
Alcali est un terme que nous utilisons couramment pour les métaux du groupe 1 du tableau périodique. Ceux-ci sont également connus sous le nom de métaux alcalins. Bien que H soit également dans ce groupe, il est quelque peu différent; il a un comportement différent des autres membres de ce groupe. Par conséquent, le lithium (li), le sodium (Na), le potassium (K), le rubidium (RB), le césium (CS) et le francium (FR) sont membres de ce groupe.
Les métaux alcalins sont des métaux de couleur douce, brillante et argentée. Ils n'ont tous qu'un seul électron dans leur coquille extérieure, et ils aiment supprimer cela et former +1 cations. Lorsque la plupart des électrons extérieurs sont excités, il revient à l'état fondamental tout en émettant un rayonnement dans la plage visible. L'émission de cet électron est facile; Ainsi, les métaux alcalins sont très réactifs. De plus, la réactivité augmente le groupe 1 du tableau périodique.

Figure 01: Hydroxyde de sodium - Un hydroxyde d'un métal alcalin
Ces métaux forment des composés ioniques avec d'autres atomes électronégatifs. Plus précisément, le terme Alcali se réfère au carbonate ou à l'hydroxyde d'un métal alcalin. Ils ont également des propriétés de base. Ils sont amers dans le goût, glissants et réagissent avec les acides, pour les neutraliser.
Qu'est-ce que la base?
Définitions
Divers scientifiques ont défini la «base» différemment. Arrhenius le définit comme une substance qui donne des oh- ions à la solution. Bronsted-lowry définit une base comme une substance qui peut accepter un proton. Selon Lewis, tout donateur d'électrons est une base. Selon la définition d'Arrhenius, un composé devrait avoir un anion d'hydroxyde et la capacité de le donner comme un ion hydroxyde pour être une base. Cependant, selon Lewis et Bronsted-Lowry, il peut y avoir des molécules, qui ne possèdent pas d'hydroxydes mais peuvent agir comme une base. Par exemple, NH3 est une base de Lewis, car elle peut donner la paire d'électrons sur l'azote. De même, na2CO3 est une base brronsted-lowry sans groupes d'hydroxyde mais peut accepter des hydrogènes.
Propriétés
Les bases ont un savon glissant comme une sensation et un goût amer. Ils réagissent facilement avec des acides produisant des molécules d'eau et de sel. Le soda caustique, l'ammoniac et le bicarbonate de soude sont quelques-unes des bases communes. Nous pouvons classer ces composés en deux groupes, en fonction de leur capacité à dissocier et à produire des ions hydroxyde. Ce sont des bases fortes et faibles. Des bases fortes comme Naoh, Koh, peuvent complètement ioniser dans une solution, pour donner des ions. Bases faibles comme NH3 dissocier partiellement et donner moins de quantités d'ions hydroxyde.

Figure 02: Hydroxyde de baryum - une base de barrium du groupe 2
De plus, kb est la constante de dissociation de base. Il indique la capacité de perdre des ions hydroxyde d'une base faible. Pour vérifier si une substance est une base ou non, nous pouvons utiliser plusieurs indicateurs comme le papier décisif ou le papier de pH. Ces composés montrent une valeur de pH supérieure à 7, et il transforme le tournesol rouge en bleu.
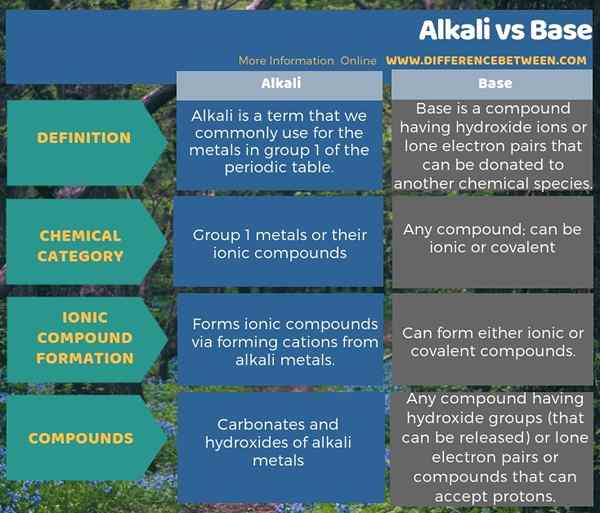
Quelle est la différence entre alcali et base?
Les métaux du groupe 1 sont appelés alcalins, ou plus précisément, leurs carbonates et hydroxydes sont appelés alcalins. Cependant, ils ont des propriétés de base; Ainsi, ils sont un sous-ensemble de bases. La principale différence entre l'alcali et la base est que les éléments du groupe 1 sont classés comme des éléments alcalins tandis que tout élément ou composé ayant des propriétés de base est classé comme une base. Par conséquent, tous les alcalis sont des bases, mais toutes les bases ne sont pas des alcalis. Une autre différence significative entre l'alcali et la base est que l'alcali forme des sels ioniques alors que les bases ne sont nécessairement pas ainsi.
L'infographie ci-dessous sur la différence entre l'alcali et la base montre ces différences dans la forme tabulaire.
Résumé - Alcali vs base
Nous utilisons souvent les deux termes alcalins et bases de manière interchangeable, mais ce sont deux termes différents. La principale différence entre l'alcali et la base est que les éléments du groupe 1 sont classés comme des éléments alcalins tandis que tout élément ou composé ayant des propriétés de base est classé comme une base.
Référence:
1. Britannica, les éditeurs de l'Encyclopaedia. "Alcali.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 14 janvier. 2014. Disponible ici
2. «Base (chimie).»Wikipedia, Wikimedia Foundation, 27 novembre. 2018. Disponible ici
Image gracieuseté:
1.«Image d'hydroxyde de sodium» par Walkerma - Propre travaux, (domaine public) via Commons Wikimedia
2.«Ba (oh) 2 octahydrate» par Leiem - propre travail, (CC By-sa 4.0) via Commons Wikimedia


