Différence entre l'acidité et la basicité

Différence clé - acidité vs basicité
L'acidité et la basicité des composés sont des indications du pH. L'acidité d'un milieu est causée par des composés acides, qui peuvent libérer+), résultant en un pH bas dans ce milieu. La basicité d'un milieu est causée par des composés de base, qui peuvent libérer des ions hydroxyde (OH-), résultant en un pH élevé dans ce milieu. La principale différence entre l'acidité et la basicité est que L'acidité provoque un pH faible tandis que la basicité provoque un pH élevé dans un milieu aqueux.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acidité
3. Qu'est-ce que la basicité
4. Comparaison côte à côte - acidité vs basicité sous forme tabulaire
5. Résumé
Qu'est-ce que l'acidité?
L'acidité est le niveau d'acide en substances. La concentration d'ions hydrogène (h+) est le principal paramètre utilisé pour identifier l'acidité. La concentration en ions hydrogène est exprimée en valeur de pH. le pH est le logarithme négatif de la concentration en ions hydrogène. Par conséquent, la concentration d'ions hydrogène à hydrogène est élevée, baissez le pH. Une faible valeur de pH indique une acidité plus élevée.
Selon l'acidité des substances, il existe deux types d'acides comme acides forts et acides faibles. Les acides forts provoquent un niveau d'acidité plus élevé dans un milieu aqueux tandis que les acides faibles entraînent une faible acidité. Les acides forts peuvent se dissocier complètement en ions, libérant tous les ions hydrogène possibles (H+). En revanche, un acide faible se dissocie partiellement, ne libérant que certains ions hydrogène. Les acides peuvent également être classés comme acides monoprotiques et acides polyprotiques; Les acides monoprotiques libèrent un ion hydrogène par molécule tandis que les acides polyprotiques libèrent plus d'ions hydrogène par molécule.
L'acidité des acides est déterminée par la PKA de l'acide. PKA est le logarithme négatif de KA. Ka est la constante de dissociation acide d'une solution. Il s'agit d'une mesure quantitative de la résistance d'un acide dans une solution (ou une acidité). Abaissez la PKA, plus l'acide est fort. La PKA plus élevée, plus l'acide est faible.

Figure 01: le jus de citron a une acidité élevée
Les tendances périodiques de l'acidité des éléments chimiques dépendent essentiellement de leurs valeurs d'électronégativité.L'électronégativité des éléments chimiques augmente de gauche à droite d'une période. Si l'électronégativité d'un atome est plus élevée, elle peut stabiliser très facilement un atome négatif car il a une affinité plus élevée pour les électrons. Par conséquent, les ions hydrogène associés à des atomes électronégatifs élevés sont facilement libérés que les atomes électronégatifs faibles, entraînant une acidité plus élevée. Lorsque vous descendez un groupe dans le tableau périodique, l'acidité augmente. C'est parce que la taille des atomes augmente dans le groupe. De grands atomes peuvent stabiliser les charges négatives sur eux (par distribution des charges); Par conséquent, un ion hydrogène associé à un grand atome peut facilement être libéré.
Qu'est-ce que la basicité?
La basicité d'une substance est le nombre d'atomes d'hydrogène remplaçables par une base dans un acide particulier. En d'autres termes, la basicité d'un composé est le nombre d'ions hydrogène qui peuvent réagir complètement avec des ions d'hydroxyde libérés par une base.
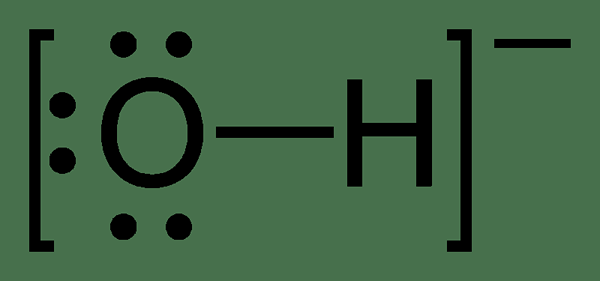
Figure 02: Structure chimique de l'ion hydroxyde
Les facteurs qui peuvent affecter la basicité d'un composé sont énumérés ci-dessous.
- Électronégativité
- Rayon atomique
- Charges officielles
L'électronégativité d'un atome fait référence à son affinité pour les électrons. Un atome ayant une électronégativité élevée peut attirer des électrons par rapport aux atomes électronégatifs faibles. L'électronégativité, plus élevée, baissez la basicité. Afin de libérer l'ion d'hydroxyde, les électrons de liaison entre l'atome d'oxygène et le reste de la molécule doivent être complètement attirés par l'atome d'oxygène (l'atome d'oxygène dans le groupe d'hydroxyde devrait être plus électronégatif que l'autre atome, il est lié). Ex: Si la basicité de ROH est élevée, l'électronégativité de R est plus petite que celle de l'atome d'oxygène.

Figure 03: Les savons sont des bases faibles formées par la réaction des acides gras avec de l'hydroxyde de sodium ou de l'hydroxyde de potassium.
Le rayon atomique est un autre facteur qui affecte la basicité d'un composé. Si le rayon atomique est petit, la densité électronique de cet atome est élevée. Par conséquent, l'ion hydroxyde peut facilement être libéré. Alors la basicité de ce composé est relativement élevée.
Les charges formelles sont généralement des charges positives ou des charges négatives. Une charge formelle positive indique une densité d'électrons moins. Par conséquent, les électrons de liaison ne peuvent pas être complètement attirés par l'ion hydroxyde. Alors il ne peut pas être facilement libéré (l'ion hydroxyde), indiquant une basicité inférieure. En revanche, une charge formelle négative provoque une basicité plus élevée.
Quelle est la différence entre l'acidité et la basicité?
Acidité vs basicité | |
| L'acidité est le niveau d'acide en substances. | La basicité fait référence à l'état d'être une base, qui peut libérer des ions hydroxyde (OH-). |
| pH | |
| L'acidité provoque un pH faible en milieu aqueux. | La basicité provoque un pH élevé dans les médiums aqueux. |
| Ions | |
| L'acidité indique une concentration élevée d'ions hydrogène dans un milieu. | La basicité indique une concentration élevée d'ions hydroxyde dans un milieu. |
| Tendances périodiques | |
| L'acidité augmente de gauche à droite une période et un groupe. | La basicité diminue de gauche à droite une période et un groupe. |
| Effet de l'électronégativité | |
| L'acidité est élevée si l'électronégativité (de l'atome à laquelle l'atome d'hydrogène est lié) est élevé. | La basicité est élevée si l'électronégativité (de l'atome à laquelle l'atome d'oxygène de l'ion hydroxyde est lié) est faible. |
Résumé - acidité vs basicité
L'acidité et la basicité sont deux termes fondamentaux utilisés en chimie. L'acidité est causée par des composés acides. La basicité est causée par des composés de base. La principale différence entre l'acidité et la basicité est que l'acidité provoque un pH faible tandis que la basicité provoque un pH élevé dans un milieu aqueux.
Référence:
1. "7.3: Effets structurels sur l'acidité et la basicité.”Chemistry LibreTexts, LibreTexts, 7 septembre. 2016, disponible ici.
2. «Tendance de table périodique.”Student Doctor Network, disponible ici.
Image gracieuseté:
1. «Lemon-edit1» par André Karwath aka aka - propre travail (CC BY-SA 2.5) Via Commons Wikimedia
2. «Hydroxyde-lone-paires-2d» (domaine public) via Commons Wikimedia
3. «589824» (CC0) via Pixabay


