Différence entre constante d'ionisation acide et constante d'ionisation de base
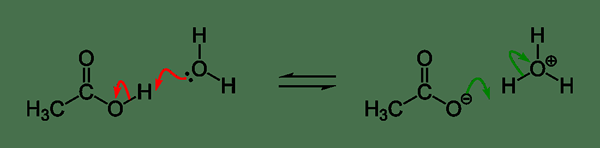
Différence clé - Ionisation acide Constant vs constante d'ionisation de base
La constante d'ionisation acide (Ka, également connue sous le nom de constante de dissociation acide) donne la mesure quantitative de l'équilibre qui existe entre les molécules acides et leurs formes ionisées. De même, la constante d'ionisation de base (KB ou constante de dissociation de base) donne la mesure quantitative de l'équilibre qui existe entre les molécules de base et leurs formes ionisées. Le différence clé entre la constante d'ionisation acide et la constante d'ionisation de base est que La constante d'ionisation acide donne une mesure quantitative de la résistance d'un acide dans une solution tandis que la constante d'ionisation de base donne une mesure quantitative de la résistance d'une base dans une solution.
L'ionisation est la séparation des molécules en espèces ioniques (cations et anions). La constante d'équilibre est la relation entre les quantités de réactifs et de produits qui sont en équilibre.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'ionisation acide constante
3. Quelle est la constante d'ionisation de base
4. Comparaison côte à côte - constante d'ionisation acide vs constante d'ionisation de base dans la forme tabulaire
5. Résumé
Qu'est-ce que l'ionisation acide constante?
La constante d'ionisation acide est le nombre qui exprime la relation entre les molécules acides et les espèces ioniques qui existent dans la même solution. La constante de dissociation acide est indiquée par KA. C'est une mesure quantitative de la résistance d'un acide dans une solution. La force d'un acide dépend de l'ionisation (ou de la dissociation) d'un acide dans une solution aqueuse.
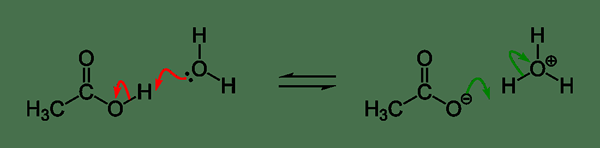
Figure 01: Un exemple d'ionisation acide
L'ionisation d'un acide peut être donnée comme ci-dessous,
Ha + h2O ↔ A- + H3O+
En cela, HA est un acide faible qui se dissocie partiellement en ions; L'anion est connue comme la base conjuguée de cet acide particulier. La dissociation acide libère un proton (ion hydrogène; h+). Ce proton se combine avec une molécule d'eau formant un ion hydronium (H3O+). La constante d'ionisation d'acide de cet acide ha peut être donnée comme ci-dessous,
Ka = [a-] [H3O+] / [Ha] [h2O]
La forme commune de kun est PKA, qui est la valeur logus du logus de KA. C'est parce que les valeurs KA sont de très petites valeurs et sont difficiles à gérer. Le PKA donne un numéro simple facile à gérer. Il peut être donné comme ci-dessous,
pka = -log (ka)
Les valeurs KA ou PKA peuvent être utilisées pour exprimer la force d'un acide.
- Les acides faibles ont des valeurs KA plus faibles et des valeurs de PKA plus élevées
- Les acides forts ont des valeurs KA plus élevées et des valeurs de PKA plus faibles.
Quelle est la constante d'ionisation de base?
La constante d'ionisation de base est le nombre qui exprime la relation entre les molécules de base et les espèces ioniques existent dans la même solution. Ceci est indiqué par KB. Il mesure la force d'une base dans une solution. Le kb plus élevé, l'ionisation de la base est élevée. Pour une certaine base d'une solution, la constante de dissociation de base peut être donnée comme ci-dessous,
B + h2O ↔ BH+ + OH-
Kb = [bh+][OH-] / [B] [h2O]
Étant donné que les valeurs KB des bases sont de très petites valeurs, la valeur de journal moins de KB est utilisée à la place KB. La valeur logus du journal de KB est indiquée par PKB. PKB donne un nombre facile à manipuler.
pkb = -log (kb)
La force d'une base peut être exprimée par les valeurs KB ou les valeurs PKB comme suit.
- La valeur de la constante d'ionisation de base est élevée, plus la base est plus forte (plus bas du PKB)
- Réduire la valeur de la constante d'ionisation de la base, plus faible de la base (le PKB) est plus élevé)
Quelle est la différence entre la constante d'ionisation acide et la constante d'ionisation de base?
Constante d'ionisation acide vs constante d'ionisation de base | |
| La constante d'ionisation acide est le nombre qui exprime la relation entre les molécules acides et les espèces ioniques existant dans la même solution. | La constante d'ionisation de base est le nombre qui exprime la relation entre les molécules de base et les espèces ioniques existant dans la même solution. |
| Concept | |
| La constante d'ionisation acide donne la force d'un acide. | La constante d'ionisation de base donne la force d'une base. |
| Valeur du journal | |
| La valeur logus du journal de KA est PKA. | La valeur logus du journal de KB est PKB. |
| Valeur de la constante | |
| Les acides faibles ont des valeurs KA plus faibles et des valeurs de PKA plus élevées tandis que les acides forts ont des valeurs KA plus élevées et des valeurs PKA plus faibles. | Les bases faibles ont des valeurs KB plus faibles et des valeurs PKB plus élevées tandis que les bases fortes ont des valeurs KB plus élevées et des valeurs PKB plus faibles. |
Résumé - Ionisation acide Constant vs constante d'ionisation de base
Constante d'ionisation acide et la constante d'ionisation de base sont des mesures respectivement des mesures d'acide et de base. La différence entre la constante d'ionisation acide et la constante d'ionisation de base est que la constante d'ionisation acide donne une mesure quantitative de la résistance d'un acide dans une solution tandis que la constante d'ionisation de base donne une mesure quantitative de la résistance d'une base dans une solution.
Référence:
1.«16.4: force acide et constante de dissociation acide (ka).”Chemistry LibreTexts, LibreTexts, 26 février. 2017. Disponible ici
2.«Bases fortes et faibles et constante d'ionisation de base (KB).»CK-12 Foundation, CK-12 Foundation, 11 septembre. 2016. Disponible ici
3.«Acides et bases: constantes d'ionisation.«Ionisation des acides et des bases. Disponible ici
Image gracieuseté:
1.«Acitic-acid-Dissociation-2d-Curly-Arrows» Ben Mills - Propre travaux, (domaine public) via Commons Wikimedia


