Différence entre le titrage acide-base et le titrage redox
Différence clé - titrage acide-base vs. Titrage redox
En général, les titrages sont utilisés pour déterminer la concentration d'une solution inconnue (analyte). Les deux méthodes Titrimétriques les plus couramment utilisées sont les titrages acides et les titrages redox. Le différence clé entre les titrages acides et les titrages redox est la nature de la réaction qui se produit entre le titrant et l'analyte dans le titrage. Dans les titrages acides, une réaction de neutralisation a lieu et dans les titrages redox, une réaction redox a lieu (une réaction oxydante et une réaction de réduction). L'utilisation des indicateurs est la méthode la plus couramment utilisée pour déterminer le point final de la réaction.
Qu'est-ce qu'un titrage acide-base?
Dans les titrages acides, un acide (titrage acide) ou une base (titrations de base) est utilisé comme titrant. Des exemples d'acides utilisés dans les titrages acides sont H2DONC4, HCL ou HNO3. Les titrants de base principalement utilisés sont naOH, k2CO3 ou na2CO3. Les titrages acides peuvent être classés comme suit en fonction de la force de l'acide et de la base.
- Acide fort - titrages de base solides
- Titraux de base faibles et faibles
- Acide faible - Titrages de base solides
- Acide faible - Titraux de base faibles
Dans la plupart des titrages acides, des indicateurs sont utilisés pour déterminer le point final de la réaction. Différents indicateurs sont utilisés en fonction du type de titrage comme mentionné ci-dessus.

Qu'est-ce qu'un titrage redox?
Une titration redox implique une réaction redox. La réaction redox a deux réactions; une réaction d'oxydation et une réaction de réduction. Les processus d'oxydation et de réduction ont lieu en même temps où nous permettant de déterminer l'achèvement de la réaction. Ceci est également connu comme le point final du titrage. Cela peut être déterminé de plusieurs manières; À l'aide d'électrodes d'indicateur, des indicateurs redox (l'indicateur produit une couleur différente à l'état d'oxydation-réduction) et des indicateurs non redox (l'indicateur produit une couleur lorsqu'un excès de titrant est ajouté).

Quelle est la différence entre le titrage acide-base et le titrage redox?
Nature de la réaction:
Titrage acide-base: Une titration acide-base implique une réaction de neutralisation entre l'analyte (la solution à la concentration inconnue) et le titrant acide ou basique.
Titrage redox: Une réaction redox implique une réaction d'oxydation et de réduction entre l'analyte et le titrant. Il n'y a pas une telle règle que le composant oxyde et que l'on réduit. L'analyte ou le titrant s'oxydisant, et le composant restant réduit en conséquence.
Détermination du point final:
Titrage acide-base: En général, un indicateur de pH, un pH compteur ou un compteur de conductance est utilisé pour déterminer le point final d'une titrage acide-base.
Titrage redox: Les méthodes les plus couramment utilisées pour déterminer le point final d'une réaction redox sont l'utilisation d'un potentiomètre ou d'un indicateur redox. Mais, le plus souvent, l'analyte ou le titrant produit une couleur au point de terminaison. De sorte que des indicateurs supplémentaires ne sont pas requis dans ces cas.
Exemples:
Titrage acide-base:
| Taper | Réaction (indicateur) |
| Acide fort - Titre de base forte | Hcl + naohànacl + h2O (phénolphthaleine / méthyl orange) |
| Acide fort - titrage de base faible | HCL + NH3à nh3Cl (méthyl orange) |
| Acide faible - Titre de base forte | Ch3COOH + Naohà Ch3Coona + H2O (Phénolphthalein) |
| Titre de base à base d'acide faible | Ch3COOH + NH3àch3ROUCOULER-+NH4+(Aucun indicateur approprié) |
Titrage redox:
2 kmno4 + 5 h2C2O4 + 6 HCl → 2 MNCL2 + 2KCL + 10 CO2 + 8 h2O
(+7) (+3) (+2) (+4)
Dans la réaction ci-dessus, le permanganate est réduit tandis que l'acide oxalique est oxydé. Une fois la réaction terminée, la couleur violette du permanganate se transforme en incolore.
Kmno4 + 5fecl2 +8hcl → 5fecl3+MNCL2+KCL + 4H2O
(+7) (+2) (+3) (+2)
Image gracieuseté:
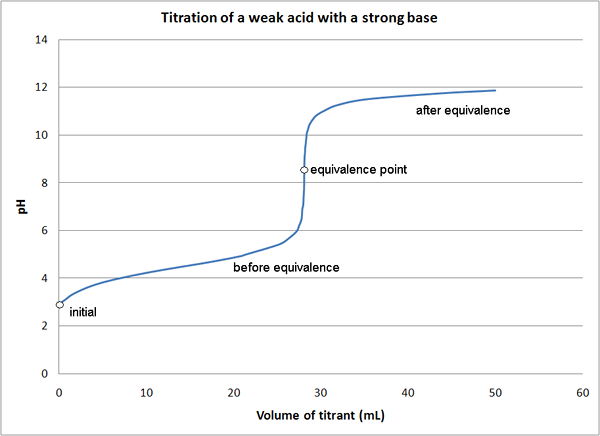
1. Titrage de l'acide faible avec une base forte par quantumkinetics (propre travail) [CC par 3.0], via Wikimedia Commons
2. «Winkler Titration Prior Titration» par Willwood [CC By-SA 3.0] via les communes


