Différence entre la réaction de base d'acide et la réaction de précipitation
Le différence clé entre la réaction de base d'acide et la réaction de précipitation est que Les réactions de base d'acide comprennent la neutralisation d'un acide d'une base ou vice versa tandis que les réactions de précipitation comprennent la formation d'un précipité après la fin de la réaction.
Il existe différents types de réactions chimiques telles que les réactions combinées, la décomposition, le déplacement unique et les réactions à double déplacement, la combustion, les réactions redox, etc. La base acide et les réactions de précipitations sont ces deux types.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une réaction de base acide
3. Qu'est-ce qu'une réaction de précipitations
4. Comparaison côte à côte - réaction de base d'acide vs réaction de précipitation réaction
5. Résumé
Qu'est-ce qu'une réaction de base acide?
Une réaction de base acide est une réaction chimique dans laquelle un acide réagit avec une base ou vice versa. Ici, une neutralisation se produit; L'acide neutralise la base ou vice versa; Par conséquent, nous pouvons également appeler cela une réaction de neutralisation. De plus, le produit final de ces réactions est un sel fait des anions d'acide et des cations de la base plus des molécules d'eau. Dans cette réaction, la rupture et la formation de liaisons peuvent se produire.
De plus, la réaction de base d'acide peut se produire de deux manières: si la réaction se produit entre un acide fort et une base forte, alors c'est essentiellement une réaction quantitative. Cela signifie; La réaction se déroule jusqu'à ce que l'acide et / ou la base soient complètement consommés. Cependant, si la réaction se produit entre un acide faible et / ou une base faible, il y aura un équilibre. Mais, ce type de réaction n'est pas quantitatif car un acide faible ou une base faible est une solution tampon.
Par exemple, la réaction entre HCl et NaOH est quantitative car le HCL est un acide fort et NaOH est une base forte.
HCL(aq) + Na (oh)(aq) → H2O + NaCl(aq)
Mais, la réaction entre l'adénine et le phosphate d'hydrogène n'est pas quantitative car l'hydrogène phosphate est un acide faible. Alors l'équilibre est le suivant:
Ah + hpo42− ⇌ A- + H2Pote−4
Qu'est-ce qu'une réaction de précipitations?
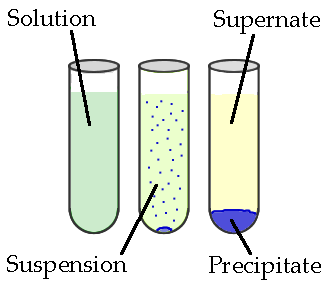
Une réaction de précipitation est un type de réaction chimique dans laquelle un précipité se forme à la fin de la réaction. Ici, les réactifs sont deux sels solubles. Ces sels se combinent les uns avec les autres pour donner un sel insoluble que nous appelons le précipité. De plus, le précipité peut exister de deux manières différentes: en tant que suspension ou masse solide qui s'enfonce au fond du récipient.

S'il s'agit d'une suspension, nous pouvons le séparer du mélange réactionnel par centrifugation, décantation ou filtration. Le liquide restant après la séparation du précipité est appelé surnageant.
Quelle est la différence entre la réaction de base d'acide et la réaction de précipitation?
La base acide et les réactions de précipitation sont deux types de réactions chimiques. La principale différence entre la réaction de base d'acide et la réaction de précipitation est que les réactions de base d'acide incluent la neutralisation d'un acide d'une base ou vice versa tandis que les réactions de précipitation comprennent la formation d'un précipité après la fin de la réaction. Le processus d'une réaction de base acide comprend la combinaison d'anions et de cations pour former un sel et une eau, tandis que le processus de réaction de précipitation comprend la formation d'un sel insoluble à partir de sels solubles.

Résumé - Réaction de base d'acide vs réaction de précipitation
En résumé, la base acide et les réactions de précipitation sont deux types de réactions chimiques. La principale différence entre la réaction de base d'acide et la réaction de précipitation est que les réactions de base d'acide incluent la neutralisation d'un acide d'une base ou vice versa tandis que les réactions de précipitation comprennent la formation d'un précipité après la fin de la réaction.
Référence:
1. Helmenstine, Anne Marie. «Définition de la réaction des précipitations."Thoughtco, Jan. 22, 2019, disponible ici.
Image gracieuseté:
1. «Diagramme de précipitations chimiques» par Zabmilenko - Propre travaux (domaine public) via Commons Wikimedia


