Différence entre l'anhydride acide et l'anhydride de base

Différence clé - Acid Anhydride vs anhydride de base
Un anhydride est un composé chimique obtenu avec l'élimination d'un composé d'eau d'un composé parent. Il y a des anhydrides organiques et des anhydrides inorganiques classés en fonction de la présence d'atomes C et H. Ces anhydrides peuvent être des anhydrides acides ou des anhydrides de base. La plupart des oxydes formés par l'élimination de l'eau d'un acide sont appelés anhydride d'acide. Les anhydrides de base ou de base sont les composés formés par l'élimination de l'eau d'une base. Le différence clé entre les anhydrides acides et les anhydrides de base est que Les anhydrides acides sont formés à partir d'acides tandis que les anhydrides de base sont formés à partir de bases.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'anhydride acide
3. Qu'est-ce que l'anhydride de base
4. Similitudes entre l'anhydride acide et l'anhydride de base
5. Comparaison côte à côte - anhydride acide vs anhydride de base sous forme tabulaire
6. Résumé
Qu'est-ce que l'anhydride acide?
Les anhydrides acides sont des composés chimiques appelés oxydes formés par l'élimination de l'eau d'un acide. Un acide est un composé chimique qui peut donner H+ ions (protons) à un moyen. Mais lorsqu'un acide est converti en anhydride, il ne peut plus libérer H+ ions. Un anhydride acide est essentiellement composé de deux groupes acyle liés au même atome d'oxygène (-c (= o) -o-c (= o))). Les oxydes acides sont souvent appelés anhydrides acides.
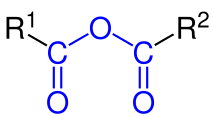
Figure 01: Un anhydride acide a deux groupes acyle liés par un atome d'oxygène (donné en bleu).
La classe la plus courante d'anhydrides acide est les anhydrides d'acide organique. Ce sont essentiellement des composés organiques. L'un des anhydrides d'acide organique les plus importants est un anhydride carboxylique. Il y a aussi des anhydrides d'acide inorganique. Ce sont essentiellement des composés inorganiques et ne contiennent aucune fraction organique. Par exemple, CO2 (le dioxyde de carbone) est un anhydride d'acide dérivé d'un acide carbonique (h2CO3). Certains autres exemples sont donnés ci-dessous.
- Anhydrides d'acide organique
- Anhydride acétique (l'anhydride d'acide organique le plus simple)
- L'anhydride maléique
- ATP sous sa forme protonée
- Anhydride acétique, formique
- Anhydrides d'acide inorganique
- Dioxyde de silicium (Sio2)
- Pentoxyde de vanadium (V2O5)
- Trioxyde de soufre (donc3)
- Trioxyde de chrome (cr2O3)
Il existe différentes façons de produire des anhydrides d'acide. Les anhydrides acides sont composés de groupes acyle hautement réactifs. La réactivité ressemble à celle des halogénures acyle. Cependant, les anhydrides acides ont tendance à être moins électrophiles que les halogénures d'acyle.
Qu'est-ce que l'anhydride de base?
Un anhydride de base ou un anhydride de base est un oxyde métallique qui forme une solution de base lors de la réaction avec l'eau. Cet oxyde métallique, la plupart du temps est soit un oxyde métallique alcalin, soit un oxyde de métal de terre alcalin (oxydes des éléments du groupe 1 ou du groupe2).

Figure 02: poudre d'oxyde de magnésium, qui est un anhydride de base.
Ces anhydrides de base sont formés en éliminant l'eau de l'hydroxyde correspondant. Par exemple, l'anhydride de base na2O est formé à partir de son hydroxyde de base, Naoh. Quelques exemples pour les anhydrides de base sont donnés ci-dessous.
- Oxyde de sodium (na2O)
- Oxyde de potassium (k2O)
- Oxyde de magnésium (MGO)
- Oxyde de calcium (CAO)
- Oxyde de baryum (Bao)
Quelles sont les similitudes entre l'anhydride acide anhydride de base?
- L'anhydride acide et l'anhydride de base sont formés par l'élimination de l'eau d'un composé chimique.
- L'anhydride acide et l'anhydride de base peuvent être convertis en forme hydrure en ajoutant de l'eau.
Quelle est la différence entre l'anhydride acide anhydride de base?
Anhydride acide vs anhydride de base | |
| Les anhydrides acides sont des composés chimiques appelés oxydes formés par l'élimination de l'eau d'un acide. | Un anhydride de base ou un anhydride de base est un oxyde métallique qui forme une solution de base lorsqu'il a réagi avec l'eau. |
| Molécule parentale | |
| L'anhydride acide est formé à partir d'un acide. | L'anhydride de base est formé à partir d'une base. |
| Acidité | |
| Les anhydrides acides sont des composés acides. | Les anhydrides de base sont des composés de base. |
| Exemples | |
| Il existe des anhydrides d'acide organique tels que l'anhydride acétique et certains anhydrides d'acide inorganique tels que le trioxyde de soufre. | Certains exemples d'anhydrides d'acide inorganique comprennent des oxydes métalliques alcalins tels que l'oxyde de sodium et les oxydes de métal de terre alcalins tels que l'oxyde de calcium. |
Résumé - Acide Anhydride vs anhydride de base
Les anhydrides sont des composés formés par élimination de l'eau d'un autre composé. Il existe deux types; anhydrides acides et anhydrides de base. La différence entre les anhydrides acides et les anhydrides de base est que les anhydrides acides sont formés à partir d'acides tandis que les anhydrides de base sont formés à partir de bases.
Téléchargez le PDF de l'anhydride acide vs l'anhydride de base
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon la note de citation. Veuillez télécharger la version PDF ici: différence entre l'anhydride acide anhydride de base
Référence:
1.Les éditeurs d'Encyclopædia Britannica. «Anhydride." Encyclopædia Britannica, Encyclopædia Britannica, Inc., 17 décembre. 2015. Disponible ici
2.Helmenstine, Anne Marie, D. «Définition de l'anhydride de base ou de base.”Thoughtco, Jun. 23, 2014. Disponible ici
3.«Anhydride d'acide organique." Wikipédia, Fondation Wikimedia, 10 février. 2018. Disponible ici
Image gracieuseté:
1.'FunktionElllegruppen Carbonsäureanhydrid'By Mache (Talk) - Propre travaux, (domaine public) via Commons Wikimedia
2.'Magnésium Oxyde' par aucun auteur lisible par machine fourni. (Domaine public) via Commons Wikimedia


