Différence entre l'acide et l'acide
Le différence clé entre l'acide et l'acide est que Le terme acide décrit les composés chimiques qui peuvent ioniser dans l'eau pour libérer des ions hydrogène tandis que le terme acide se réfère à la capacité de libérer des ions hydrogène.
Les acides sont des substances ayant une valeur de pH inférieure à 7 et ils réagissent avec les métaux et les bases. De plus, une caractéristique des acides est qu'ils ont un goût aigre. Cependant, le terme acide est un adjectif que nous utilisons pour décrire les propriétés d'une substance qui a des propriétés similaires à un acide.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acide
3. Qu'est-ce que l'acide
4. Comparaison côte à côte - acide vs acide sous forme tabulaire
5. Résumé
Qu'est-ce que l'acide?
L'acide est un composé chimique qui peut libérer des ions hydrogène dans l'eau. De plus, les acides ont une valeur de pH inférieure à 7, et ils ont également un goût aigre. De plus, il existe trois grandes catégories d'acides. À savoir, ce sont des acides forts, des acides modérément forts et des acides faibles. L'acide fort ionise complètement pour libérer tous les ions hydrogène possibles à la solution aqueuse tandis que l'acide faible ionise partiellement.
De plus, il existe deux grandes catégories d'acides. À savoir, ce sont des acides Brønsted et Lewis. Les acides Brønsted sont les donateurs de protons. Dans les solutions aqueuses, elles peuvent former des ions hydronium (H3O+) en donnant un proton (h+) à la molécule d'eau (h2O). Les acides Lewis sont des composés chimiques qui peuvent former une liaison covalente avec une paire d'électrons.
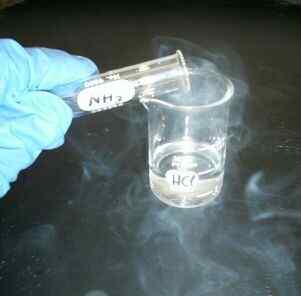
Figure 01: Réaction entre l'acide HCl et la base NH4OH
Nous pouvons mesurer la résistance à l'acide de l'acide à partir de la constante de dissociation acide ou kun. Cela donne à quel point un acide se dissocie dans ses ions. Pour la dissociation de l'acide ha en H+ et un- ions, nous pouvons écrire une équation pour déterminer le kun Valeur comme suit:
Kun = [H+][UN-] / [Ha]
Une base peut neutraliser un acide. La réaction entre un acide et une base donne du sel et de l'eau. Par exemple, la réaction entre l'acide HCl et la base de NaOH donne du sel de NaCl et une molécule d'eau.
Qu'est-ce que l'acide?
Le terme acide est utile pour décrire les propriétés d'une substance qui a des propriétés similaires à un acide. Ou bien, nous pouvons l'utiliser pour exprimer la présence d'un acide. Parfois, nous utilisons ce terme pour donner une idée du pH d'une solution comme pH<7 (pH is below 7).

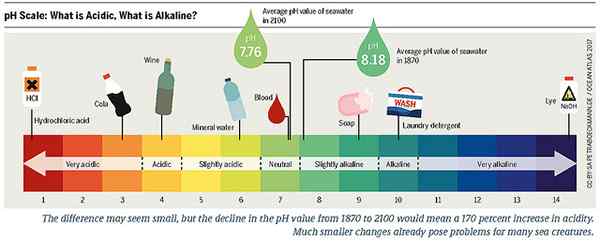
Figure 02: Échelle de pH pour les substances acides et alcalines
Par exemple, les aliments sont appelés alcalins ou acides en fonction de leur capacité à produire des cendres de base ou acides à l'intérieur de l'estomac après leur digestion. C'est pourquoi nous classons les aliments comme alcalins ou acides, et les médecins nous conseillent d'inclure de plus en plus d'aliments alcalins dans notre alimentation. Lorsque nous mangeons des aliments, ils s'oxydent à l'intérieur du corps, et après la digestion, ils laissent un résidu ou une cendre. Si ce résidu contient des minéraux tels que le soufre, le phosphore, le chlore et les radicaux d'acide organique plus que le sodium, le potassium, le calcium et le magnésium, les aliments sont appelés admiration. En revanche, l'inverse de ce phénomène est également vrai, et les aliments sont ensuite appelés alcalins.
Quelle est la différence entre l'acide et l'acide?
Un acide est un composé chimique qui peut libérer des ions hydrogène dans l'eau alors que le terme acide est utile pour décrire les propriétés d'une substance qui a des propriétés similaires à un acide. Par conséquent, c'est la principale différence entre l'acide et l'acide. En bref, le terme acide est utile pour nommer un composé chimique tandis que le terme acide est utile pour expliquer la présence de propriétés d'un acide.

Résumé - acide vs acide
Le terme acide dérive du nom acide. La principale différence entre l'acide et l'acide est que le terme acide décrit les composés chimiques qui peuvent ioniser dans l'eau pour libérer des ions hydrogène tandis que le terme acide se réfère à la capacité de libérer des ions hydrogène.
Référence:
1. "Acide.»Wikipedia, Wikimedia Foundation, 30 octobre. 2018. Disponible ici
2. «Aide | Définition de l'acide en anglais par les dictionnaires d'Oxford.«Dictionnaires d'Oxford | Anglais, dictionnaires d'Oxford. Disponible ici
Image gracieuseté:
1.«Ammoniac d'acide chlorhydrique» (domaine public) via les communes Wikimedia
2.”35805740223" par Heinrich-Böll-Stiftung (CC By-Sa 2.0) via Flickr


