Différence entre l'acide faible et fort
Le différence clé entre l'acide faible et fort est que Les acides faibles ionisent partiellement dans l'eau alors que les acides puissants ionisent complètement.
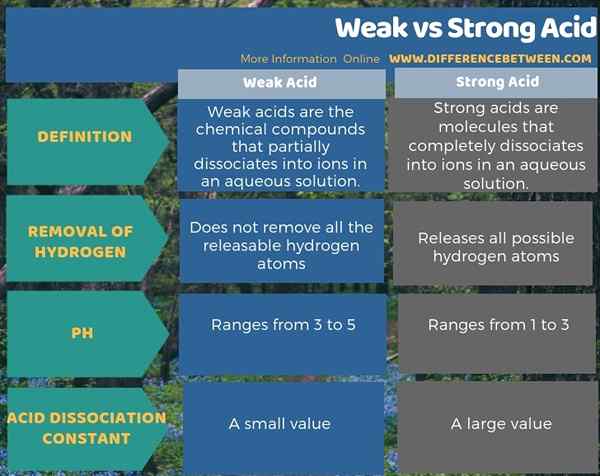
La force d'un acide est sa capacité à ioniser ou à donner l'ion hydrogène dans une solution aqueuse réagissant avec l'eau. Plus un acide ionise, plus il est fort et moins la production d'ions hydrogène indique un acide faible. C'est la différence entre un acide fort et un acide faible. La concentration d'ions dans une solution aqueuse d'un acide indique à quel point un acide est fort ou faible. Ainsi, vous pouvez avoir une solution concentrée d'un acide faible, et il est parfaitement possible d'avoir une solution diluée d'un acide fort.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acide faible
3. Qu'est-ce que l'acide fort
4. Comparaison côte à côte - faible vs acide fort sous forme tabulaire
5. Résumé
Qu'est-ce que l'acide faible?
L'acide faible fait référence aux composés chimiques qui se dissocient partiellement en ions dans une solution aqueuse. Ils ne libèrent pas la quantité totale d'ions hydrogène relemables (H+) dans la solution. Pour ces acides, la constante de dissociation acide ou kun est une petite valeur. Le pH de ces solutions se situe autour de 3 à 5. Principalement, c'est parce que ces acides faibles ne peuvent pas augmenter la teneur en ions hydrogène dans la solution autant qu'un acide fort.

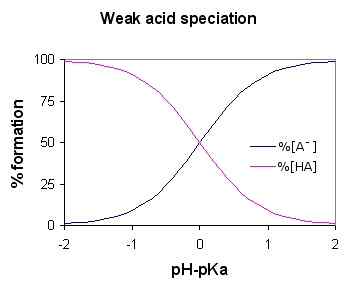
Figure 01: Diagramme de spéciation à l'acide faible (pour l'acide faible HA)
Étant donné que l'acide faible se dissocie partiellement, la solution aqueuse contient trois composants majeurs; Les ions hydrogène, les molécules d'acide syndiqué et la base conjuguée (anion lié à l'ion hydrogène dans la molécule acide). Certains exemples courants incluent l'acide sulfureux, l'acide phosphorique, l'acide nitreux, etc.
Qu'est-ce que l'acide fort?
L'acide fort fait référence aux molécules qui se dissocient complètement en ions dans une solution aqueuse. Par conséquent, ces composés ionisent complètement dans l'eau. La valeur de la constante de dissociation acide ou KA est une valeur élevée pour ce type d'acides. Plus fort de l'acide, la libération d'ions hydrogène est plus facile. Principalement, cela se produit en raison de la forte polarité de la liaison H-A dans laquelle H est un atome d'hydrogène, et A est la base conjuguée. Pour être très polaire, la différence d'électronégativité entre les atomes de chaque côté de cette liaison doit être élevée.
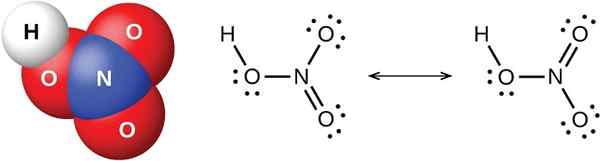
Figure 02: Structure chimique de l'acide fort HNO3 (acide nitrique)
De plus, cette libération d'ions hydrogène dépend également de la taille de l'anion (base conjuguée) à laquelle l'ion hydrogène est attaché. Si l'anion est grand et plus stable, il peut facilement libérer l'ion hydrogène. Contrairement aux acides faibles, ces acides forts libèrent tous les ions hydrogène possibles à la solution aqueuse. La valeur du pH de ces solutions aqueuses est très petite; peut varier de 1 à 3.
Quelle est la différence entre l'acide faible et fort?
Les acides faibles ionisent partiellement dans l'eau alors que les acides puissants ionisent complètement. Par conséquent, l'ionisation est la principale différence entre l'acide faible et fort. De plus, une autre différence entre l'acide faible et fort est que l'acide faible n'élève pas tous les atomes d'hydrogène relemables. Au contraire, l'acide fort libère tous les atomes d'hydrogène possibles.
En outre, il existe une différence entre l'acide faible et fort en fonction de leur valeur de pH. C'est-à-dire; La valeur du pH des acides faibles varie de 3 à 5 tandis que celle des acides forts varie de 1 à 3. De plus, la constante de dissociation acide contribue à une autre différence entre l'acide faible et fort. Dissociation acide La constante de l'acide faible est faible par rapport à l'acide fort.
Résumé - Faible vs acide fort
Les acides sont des molécules qui peuvent libérer des ions hydrogène à une solution aqueuse. Nous pouvons classer tous les acides comme des acides forts, des acides modérément forts et des acides faibles. En bref, la principale différence entre l'acide faible et fort est que les acides faibles ionisent partiellement dans l'eau tandis que les acides puissants ionisent complètement.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Liste des acides forts et faibles.”Thoughtco, sept. 24, 2018. Disponible ici
2. Helmenstine, Anne Marie, Ph.D. «Définition de l'acide faible et exemples en chimie.”Thoughtco, Jun. 18, 2018. Disponible ici
Image gracieuseté:
1.«Spéciation d'acide faible» par P. Gans et transféré par leaw., (Domaine public) via Commons Wikimedia
2."CNX Chem 18 09 HNO3" par OpenStax (CC par 4.0) via Commons Wikimedia


