Différence entre l'acétylène et l'éthylène

Différence clé - acétylène vs Éthylène
Le différence clé entre l'acétylène et l'éthylène L'acétylène a une triple liaison entre deux atomes de carbone alors que l'éthylène a une double liaison entre deux atomes de carbone.
Les noms de l'acétylène et de l'éthylène semblent similaires, mais ce sont des composés d'hydrocarbures différents. Cependant, ils ont également quelques similitudes. Cet article décrit à la fois les similitudes et les différences entre l'acétylène et l'éthylène.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acétylène
3. Qu'est-ce que l'éthylène
4. Similitudes entre l'acétylène et l'éthylène
5. Comparaison côte à côte - acétylène vs éthylène sous forme tabulaire
6. Résumé
Qu'est-ce que l'acétylène?
L'acétylène est un composé organique ayant la formule chimique C2H2. De plus, c'est l'alcyne la plus simple parmi les hydrocarbures. Un alcyne est un composé ayant une triple liaison entre deux atomes de carbone. Par conséquent, l'acétylène a une triple liaison entre les deux atomes de carbone qu'il a. Il y a deux liaisons Pi et une liaison sigma entre ces atomes de carbone. La molécule a une géométrie linéaire car un atome de carbone ne peut former que quatre liaisons covalentes (l'acétylène a une triple liaison et une seule liaison, C-H, qui rend la molécule linéaire). Par conséquent, les atomes de carbone de la molécule d'acétylène sont hybrides SP.
Propriétés chimiques de l'acétylène
Certains faits chimiques sur l'acétylène sont les suivants:
- Formule chimique = C2H2
- Masse molaire = 26.04 g / mol
- État physique à température ambiante = c'est un gaz incolore
- Odeur = inodore
- Point de fusion = -80.8 ° C
- Point d'ébullition = -84 ° C
- Solubilité dans l'eau = légèrement soluble
- Name iupac = Ethyne
De plus, l'acétylène n'existe pas comme un liquide dans la pression atmosphérique. Ainsi, il n'a pas de point de fusion réel. La température de fusion donnée ci-dessus est en fait le triple point de l'acétylène. Par conséquent, la forme solide de l'acétylène subit une sublimation plutôt que de fondre. Là, l'acétylène solide est converti en vapeur.

Figure 01: Utilisation de la flamme oxy-acétylène
L'application principale de l'acétylène est en cours de soudage. La flamme oxy-acétylène est une flamme à haute température qui est importante pour le soudage et la coupe. Nous pouvons produire cette flamme à partir de la combustion de l'acétylène avec de l'oxygène.
Qu'est-ce que l'éthylène?
L'éthylène est un composé organique ayant la formule chimique C2H4. Il y a deux atomes de carbone liés l'un à l'autre via une double liaison (une liaison PI et une liaison Sigma). Par conséquent, la molécule d'éthylène a deux atomes de carbone hybridés SP2. Puisqu'un atome de carbone est capable de former quatre liaisons chimiques, il y a deux atomes d'hydrogène liés à chaque atome de carbone via des liaisons uniques. Ensuite, la molécule d'éthylène a une structure planaire.
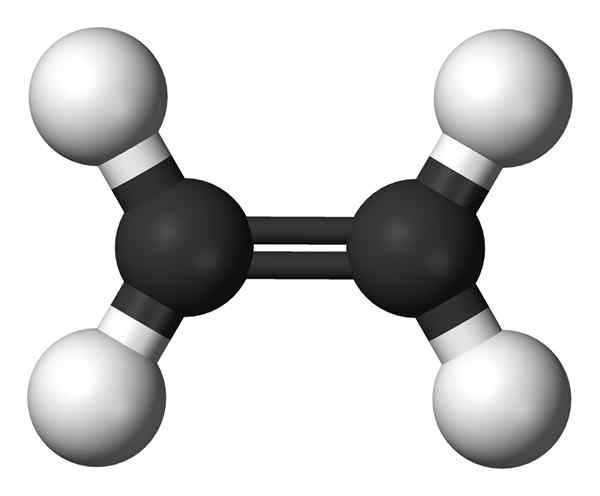
Figure 02: La structure chimique de l'éthylène
Certains faits chimiques sur l'éthylène sont les suivants:
- Formule chimique = C2H4
- Masse molaire = 28.05 g / mol
- État physique à température ambiante = c'est un gaz inflammable incolore et inflammable
- Odeur = odeur douce
- Point de fusion = −169.2 ° C
- Point d'ébullition = −103.7 ° C
- Solubilité dans l'eau = légèrement soluble
- Nom IUPAC = Ethène
La principale source d'éthylène est le pétrole brut et les gaz naturels. Il y a trois processus principaux utilisés pour produire de l'éthylène à partir de ces sources. Ils sont;
- Fissure à la vapeur de l'éthane et du propane
- Craquage à la vapeur de naphtha
- Craquage catalytique d'huile de gaz
L'éthylène possède des utilisations importantes comme monomères pour la production de polymères tels que le polyéthylène via une polymérisation d'addition. Le polyéthylène est un matériau d'emballage commun. De plus, dans les systèmes biologiques, l'éthylène est important comme hormone végétale car elle stimule le processus de maturation des fruits.
Quelles sont les similitudes entre l'acétylène et l'éthylène?
- Les deux sont de petits hydrocarbures.
- L'acétylène et l'éthylène ne sont composés que d'atomes de carbone et d'atomes d'hydrogène.
- Les deux sont des gaz incolores.
- L'acétylène et l'éthylène sont des gaz inflammables.
- L'acétylène et l'éthylène sont des structures planes.
Quelle est la différence entre l'acétylène et l'éthylène?
Acétylène vs éthylène | |
| L'acétylène est un composé organique ayant la formule chimique C2H2. | L'éthylène est un composé organique ayant la formule chimique C2H4. |
| Nombre d'atomes d'hydrogène | |
| L'acétylène a deux atomes d'hydrogène dans une molécule d'acétylène. | L'éthylène a quatre atomes d'hydrogène dans une molécule d'éthylène. |
| Masse molaire | |
| La masse molaire de l'acétylène est de 26.04 g / mol. | La masse molaire de l'éthylène est de 28.05 g / mol. |
| Liaison chimique | |
| L'acétylène a une triple liaison entre deux atomes de carbone et deux liaisons simples C-H. | L'éthylène a une double liaison entre deux atomes de carbone et quatre liaisons simples C-H. |
| Hybridation des atomes de carbone | |
| Les atomes de carbone de la molécule d'acétylène sont hybridés SP. | Les atomes de carbone de la molécule d'éthylène sont hybridés SP2. |
Résumé - Acétylène vs Éthylène
L'acétylène et l'éthylène sont des composés d'hydrocarbures très importants en raison de leur large gamme d'applications. La différence entre l'acétylène et l'éthylène est que l'acétylène a une triple liaison entre deux atomes de carbone tandis que l'éthylène a une double liaison entre deux atomes de carbone.
Référence:
1. "Acétylène.»Wikipedia, Wikimedia Foundation, 14 avril. 2018. Disponible ici
2. "Éthylène.»Wikipedia, Wikimedia Foundation, 18 avril. 2018. Disponible ici
3. "Acétylène.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
Image gracieuseté:
1.'US Navy 070413-N-2943C-001 Technicien de coque Fireman Troy Heffner illumine une torche d'acétyle d'oxygène avant un travail de soudage dans le technicien de coque Shop'by U.S. Navy Photo par le spécialiste de la communication de masse Carlos Cepeda (domaine public) via Commons Wikimedia
2.«Ethylène-3D-Balls» Benjah-Bmm27 - Propre travaux, (domaine public) via Commons Wikimedia


