Quelle est la différence entre l'acide monoprotique et diprotique
Le différence clé entre l'acide monoprotique et diprotique est que les acides monoprotiques sont capables de donner un atome d'hydrogène ou un proton à leur solution aqueuse, tandis que les acides diprotiques sont capables de donner deux atomes ou protons d'hydrogène à leur solution aqueuse.
Les composés d'acide monoprotique et diprotique sont deux groupes significatifs de substances acides. Ces composés sont capables de libérer des protons à leurs solutions aqueuses.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'un acide monoprotique
3. Qu'est-ce qu'un acide diprotique
4. Monoprotique vs acide diprotique sous forme tabulaire
5. Résumé - monoprotique vs acide diprotique
Qu'est-ce qu'un acide monoprotique?
Un acide monoprotique est un acide composé d'un atome d'hydrogène ionisable par molécule. Ce type d'acide ne peut donner qu'un seul proton ou atome d'hydrogène d'une molécule d'acide à sa solution aqueuse. D'un autre côté, les acides qui peuvent donner plus d'un proton ou un atome d'hydrogène à la solution aqueuse sont appelés acides polyprotiques. Ces acides polyprotiques peuvent être classés davantage en groupes en fonction du nombre de protons qui sont donnés par chaque molécule. Par exemple, si une molécule d'acide donne deux protons ou atomes d'hydrogène, il est connu sous le nom d'acide diprotique; Si trois sont donnés, il est connu sous le nom d'acide triprotique, et ainsi de suite.
En règle générale, la charge électrique d'un acide monoprotique peut sauter à un niveau supérieur avant de pouvoir donner le proton. De plus, nous pouvons prédire que tout acide ayant un atome d'hydrogène par molécule est un acide monoprotique. Par conséquent, tous les acides monomydrogène sont monoprotiques. Cependant, tous les acides monoprotiques n'ont pas un seul atome d'hydrogène. Par exemple, il peut y avoir des composés avec plus d'un atome d'hydrogène par molécule, mais ils pourraient être en mesure de ne libérer qu'un seul atome d'hydrogène.
De plus, puisque un seul atome d'hydrogène est donné, nous pouvons facilement prédire et calculer le pH d'un acide monoprotique. En revanche, une base monoprotique ne peut accepter qu'un seul proton ou atome d'hydrogène. Certains exemples d'acides monoprotiques comprennent l'acide chlorhydrique, l'acide nitrique, l'acide acétique, etc.
Qu'est-ce qu'un acide diprotique?
Les molécules d'acide diprotique sont des acides qui peuvent donner deux protons ou atomes d'hydrogène par molécule. Ce type d'acide est capable de donner deux protons à sa solution aqueuse. Le terme opposé pour la diprotique est monoprotique (ce qui signifie un proton ou un atome d'hydrogène par molécule). Certains exemples courants d'acides diprotiques incluent l'acide sulfurique, l'acide carbonique et l'acide oxalique.

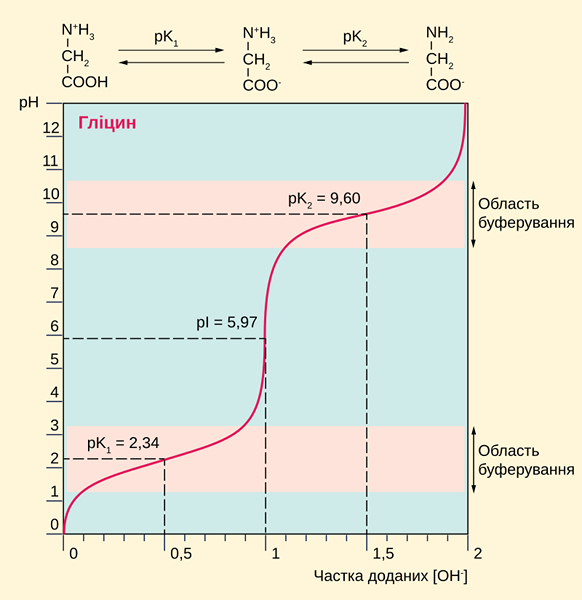
Figure 01: La glycine est un acide diprotique (Cette courbe montre les valeurs de pH auxquelles les deux protons sont donnés à la solution aqueuse)
Les acides diprotiques sont capables de produire deux ions H + par molécule d'acide. Par conséquent, ces acides peuvent augmenter la concentration en ions hydrogène des solutions et, ainsi, diminuer la valeur du pH due à une acidité élevée. Nous pouvons identifier un acide diprotique en le titrant avec une solution d'hydroxyde de sodium ayant une concentration connue.
Quelle est la différence entre l'acide monoprotique et diprotique?
La principale différence entre l'acide monoprotique et diprotique est que les acides monoprotiques sont capables de donner un atome ou un proton d'hydrogène à leur solution aqueuse, tandis que les acides diprotiques sont capables de donner deux atomes d'hydrogène ou protons à leur solution aqueuse. L'acide chlorhydrique, l'acide nitrique et l'acide acétique sont des exemples d'acides monoprotiques, tandis que l'acide sulfurique, l'acide carbonique et l'acide oxalique sont des exemples d'acides diprotiques. Dans l'ensemble, les acides monoprotiques sont plus acides que les acides diprotiques.
L'infographie ci-dessous présente les différences entre l'acide monoprotique et diprotique sous forme tabulaire pour une comparaison côte à côte.
Résumé - monoprotique vs acide diprotique
La principale différence entre l'acide monoprotique et diprotique est que les acides monoprotiques sont capables de donner un atome ou un proton d'hydrogène à leur solution aqueuse, tandis que les acides diprotiques sont capables de donner deux atomes d'hydrogène ou protons à leur solution aqueuse.
Référence:
1. Helmenstine, Anne Marie. «Définition de l'acide monoprotique."Thoughtco, août. 27, 2020.
Image gracieuseté:
1. «Courbe de titrage de glycine» par Zlir'a - Propre travaux (CC0) via Commons Wikimedia


