Quelle est la différence entre l'équilibre ionique et l'équilibre chimique
Le différence clé entre l'équilibre ionique et l'équilibre chimique Est-ce que l'équilibre ionique se produit entre les molécules syndiquées et les ions dans un électrolyte, tandis que l'équilibre chimique se produit entre les réactifs chimiques et les produits.
L'équilibre ionique et chimique est un phénomène important en chimie. L'équilibre ionique est l'équilibre qui est établi entre les molécules syndiquées et les ions dans une solution d'électrolytes faibles. L'équilibre chimique est l'état dans lequel les réactifs et les produits sont présents dans des concentrations qui n'ont plus tendance à changer avec le temps.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'équilibre ionique
3. Qu'est-ce que l'équilibre chimique
4. Équilibre ionique vs équilibre chimique sous forme tabulaire
5. Résumé - Équilibre ionique vs équilibre chimique
Qu'est-ce que l'équilibre ionique?
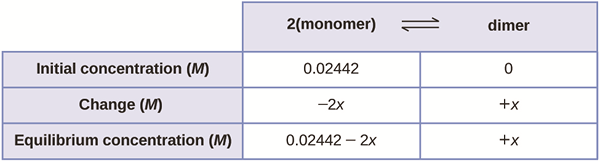
L'équilibre ionique peut être décrit comme l'équilibre établi entre les molécules syndiquées et les ions dans une solution d'électrolytes faibles. Généralement, le pH mesure l'acidité ou l'alcalinité d'une solution. En effet, les acides ont tendance à libérer des ions hydrogène dans la solution. Si un sel peu soluble est dissous dans l'eau, un équilibre ionique est créé.
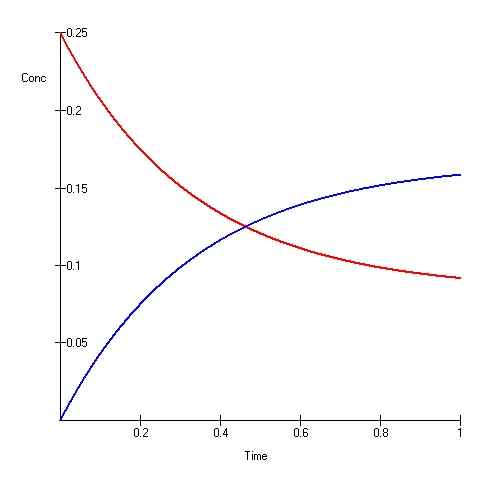
L'équilibre ionique est également un type d'équilibre où les quantités de produits et de réactifs ne changent pas avec le temps. Cependant, cela ne signifie pas que la réaction s'est arrêtée; La réaction se déroule plutôt d'une manière qui maintient les montants inchangés (le changement net est nul).
L'équilibre ionique est également connu comme un «équilibre dynamique.«Dans ce type d'équilibre, la réaction est réversible et continue. Pour qu'un équilibre dynamique ait lieu, le système doit être fermé afin qu'aucune énergie ou matière ne s'échappe du système.
Qu'est-ce que l'équilibre chimique?
L'équilibre chimique peut être décrit comme l'état dans lequel les réactifs et les produits sont présents dans des concentrations qui n'ont plus tendance à changer avec le temps. Certaines réactions sont réversibles et certaines réactions sont irréversibles. Dans une réaction, les réactifs se convertissent en produits. Dans certaines réactions, les réactifs sont à nouveau générés à partir des produits. Par conséquent, ce type de réaction est réversible.
Dans des réactions irréversibles, une fois que les réactifs sont convertis en produits, ils ne se régénèrent pas à partir des produits. Dans une réaction réversible, lorsque les réactifs vont aux produits, nous l'appelons une réaction avant, et lorsque les produits vont réactifs, c'est une réaction vers l'arrière.

Lorsque la vitesse des réactions vers l'avant et vers l'arrière est égale, alors la réaction est à l'équilibre. Par conséquent, pendant un certain temps, la quantité de réactifs et de produits ne changent pas. Les réactions réversibles ont toujours tendance à venir à l'équilibre et à maintenir cet équilibre. Lorsque le système est à un équilibre, la quantité de produits et les réactifs ne sont pas nécessairement égaux. Il peut y avoir une quantité plus élevée de réactifs que les produits ou vice versa. La seule exigence d'une équation d'équilibre est le maintien d'une quantité constante des deux dans le temps. Pour une réaction en équilibre, nous pouvons définir une constante d'équilibre comme: où elle est égale au rapport entre la concentration de produits et la concentration des réactions.
Pour une réaction d'équilibre, si la réaction avant est exothermique, alors la réaction vers l'arrière est endothermique et vice versa. Normalement, tous les autres paramètres pour les réactions avant et arrière sont opposées aux autres comme celle-ci. Par conséquent, si nous voulons faciliter l'une ou l'autre des réactions, nous devons simplement ajuster les paramètres pour faciliter cette réaction.
Quelle est la différence entre l'équilibre ionique et l'équilibre chimique?
L'équilibre ionique et chimique est un phénomène important en chimie. La principale différence entre l'équilibre ionique et l'équilibre chimique est que l'équilibre ionique se produit entre les molécules syndiquées et les ions dans un électrolyte, tandis que l'équilibre chimique se produit entre les réactifs chimiques et les produits.
L'infographie ci-dessous présente les différences entre l'équilibre ionique et l'équilibre chimique sous forme tabulaire pour la comparaison côte à côte.
Résumé - Équilibre ionique vs équilibre chimique
L'équilibre ionique est l'équilibre qui est établi entre les molécules syndiquées et les ions dans une solution d'électrolytes faibles. L'équilibre chimique est l'état dans lequel les réactifs et les produits sont présents dans des concentrations qui n'ont plus tendance à changer avec le temps. La principale différence entre l'équilibre ionique et l'équilibre chimique est que l'équilibre ionique se produit entre les molécules syndiquées et les ions dans un électrolyte, tandis que l'équilibre chimique se produit entre les réactifs chimiques et les produits.
Référence:
1. «Introduction, types et fonction de l'équilibre ionique." Kullab.
Image gracieuseté:
1. «CNX Chem 13 04 Iceable25 IMG» par OpenStax - (CC par 4.0) via Commons Wikimedia
2. «Equilibre chimique» par V8rik au Wikipedia en langue anglaise (CC BY-SA 3.0) via Commons Wikimedia


