Quelle est la différence entre la transition de phase du premier et du deuxième ordre
Le Différence clé entre la transition de phase du premier et du deuxième ordre Est-ce que les transitions de phase du premier ordre dépendent de la première puissance de la concentration de réactif dans une équation de taux, tandis que les transitions de phase de seconde ordre dépendent de la deuxième puissance de la concentration dans l'équation de vitesse.
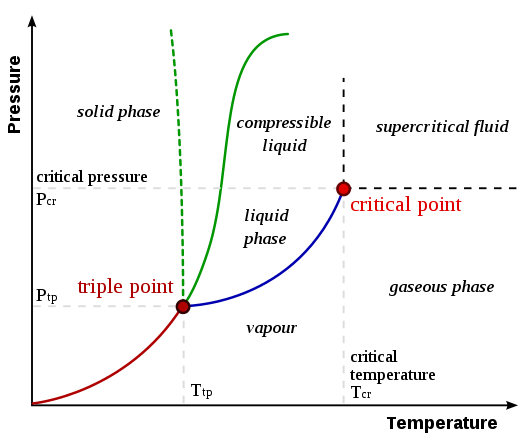
Une transition de phase est un changement de phase de matière, qui est un processus physique de transition d'un état d'un milieu à un état différent du même milieu, qui est identifié par des paramètres tels que la densité et le volume. Généralement, ce terme est utilisé pour décrire des phases telles que le solide, le liquide, le gaz et le plasma. Les types de transitions de phase comprennent la fusion, l'ébullition, la sublimation, la vaporisation, l'ionisation, le dépôt, la condensation et la recombinaison.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la transition de phase de premier ordre
3. Qu'est-ce que la transition de phase du second ordre
4. Première transition de phase du second ordre sous forme tabulaire
5. Résumé - Transition de phase de premier ordre contre le second ordre
Qu'est-ce que la transition de phase de premier ordre?
Les transitions de phase du premier ordre sont les réactions chimiques dans lesquelles la vitesse de réaction dépend de la concentration molaire de l'un des réactifs impliqués dans la réaction. Par conséquent, la somme des pouvoirs auxquels les concentrations de réactifs sont augmentées dans l'équation de la loi taux seront toujours 1. Si un seul réactif participe à ces réactions, la concentration de ce réactif détermine la vitesse de la réaction. Mais parfois, il y a plus d'un réactif participant à ces réactions. Dans de tels cas, l'un de ces réactifs déterminera la vitesse de la réaction.

Nous pouvons caractériser une transition de phase de premier ordre par la discontinuité des variables thermodynamiques, y compris la densité et l'entropie. De plus, ce type de transition est généralement affiché par des modifications de volume.
Qu'est-ce que la transition de phase du second ordre?
Les transitions de phase du second ordre sont des réactions chimiques dans lesquelles la vitesse de réaction dépend de la concentration molaire de deux des réactifs ou de la deuxième puissance d'un réactif impliqué dans la réaction. Par conséquent, la somme des pouvoirs auxquels les concentrations de réactifs sont augmentées dans l'équation de la loi sur les taux seront toujours 2. S'il y a deux réactifs, la vitesse de réaction dépendra de la première puissance de la concentration de chaque réactif.
Une deuxième transition de phase est également connue sous le nom de transition de phase continue car elle se caractérise par une sensibilité divergente, une décomposition de la loi du pouvoir de corrélations près de la criticité, etc. La théorie derrière les transitions de phase du second ordre a été développée par des scientifiques utilisant la théorie Landau.
Quelle est la différence entre la transition de phase du premier et du deuxième ordre?
Les réactions du premier ordre et du second ordre peuvent se produire sous forme de transitions de phase. La principale différence entre la transition de phase du premier et du deuxième ordre est que les transitions de phase de premier ordre dépendent de la première puissance de la concentration réactive dans une équation de taux, tandis que les transitions de phase de seconde ordre dépendent de la deuxième puissance de la concentration dans l'équation de vitesse.
Vous trouverez ci-dessous un résumé de la différence entre la transition de phase du premier et du deuxième ordre sous forme tabulaire pour une comparaison côte à côte.
Résumé - Transition de phase de premier ordre contre le second ordre
Les transitions de phase du premier ordre sont les réactions chimiques dans lesquelles la vitesse de réaction dépend de la concentration molaire de l'un des réactifs impliqués dans la réaction. Les réactions du second ordre, en revanche, sont des réactions chimiques dans lesquelles la vitesse de réaction dépend de la concentration molaire de deux des réactifs ou de la deuxième puissance d'un réactif impliqué dans la réaction. La principale différence entre la transition de phase du premier et du deuxième ordre est que les transitions de phase de premier ordre dépendent de la première puissance de la concentration réactive dans une équation de taux, tandis que les transitions de phase de seconde ordre dépendent de la deuxième puissance de la concentration dans l'équation de vitesse.
Référence:
1. «Commandez la transition de phase." Un aperçu | Sujets ScienceDirect.
Image gracieuseté:
1. «Phase-diag2» par Matthieumarechal (CC By-Sa 3.0) via Commons Wikimedia


