Quelle est la différence entre l'enthalpie et l'enthalpie molaire
Le Différence clé entre l'enthalpie et l'enthalpie molaire Est-ce que l'enthalpie est le contenu thermique total d'un système thermodynamique, tandis que l'enthalpie molaire est la chaleur totale par mole de réactif dans le système.
L'enthalpie et l'enthalpie molaire sont des termes utiles en chimie physique pour la détermination du contenu thermique total dans un système thermodynamique. Nous pouvons définir un système thermodynamique comme un corps de matière ou de rayonnement qui est confiné par des murs ayant certaines perméabilités qui peuvent séparer ce système de l'environnement.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'enthalpie
3. Qu'est-ce que l'enthalpie molaire
4. Enthalpie et enthalpie molaire sous forme tabulaire
5. Résumé - Enthalpie vs molaire enthalpie
Qu'est-ce que l'enthalpie?
L'enthalpie d'un système est une quantité thermodynamique équivalente au contenu thermique total d'un système. Il est égal à l'énergie interne du système plus le produit de la pression et du volume. Par conséquent, il s'agit d'une propriété thermodynamique d'un système.
L'équation de l'enthalpie est donnée ci-dessous.
H = u + pv
Dans l'équation ci-dessus, H est l'enthalpie du système, U est l'énergie interne du système, P est la pression et V est le volume. L'enthalpie d'un système est l'indication de la capacité de ce système à libérer la chaleur (à faire un travail non mécanique). L'enthalpie est indiquée par le symbole H.

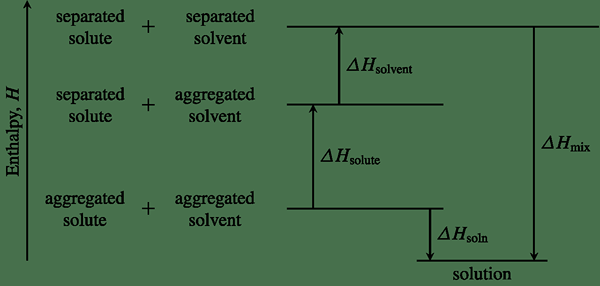
Figure 01: Un diagramme d'enthalpie montrant les changements d'enthalpie pour une réaction chimique particulière
La détermination de l'enthalpie d'un système nous permet d'indiquer si une réaction chimique est exothermique ou endothermique. Le changement d'enthalpie d'un système peut être utilisé pour déterminer la chaleur des réactions et pour prédire si une réaction chimique est spontanée ou non spontanée.
Qu'est-ce que l'enthalpie molaire?
L'enthalpie molaire est la valeur d'enthalpie donnée par mole. Dans cette définition, l'enthalpie est une quantité thermodynamique équivalente au contenu thermique total d'un système. Il est égal à l'énergie interne du système plus le produit de la pression et du volume. L'unité de mesure pour cette valeur est KJ / mol. Par conséquent, nous pouvons dériver l'équation de la détermination de l'enthalpie molaire comme suit:
Enthalpie molaire = dh / n
Où DH est le changement d'enthalpie du système, «n» est le nombre de moles de réactif impliqués dans le système. Par exemple, l'enthalpie molaire pour la formation d'une substance particulière est le changement d'enthalpie lorsqu'une taupe d'espèces chimiques se forme à l'état standard à une température spécifiée. Cette formation de la substance se produit à partir de la forme la plus stable des éléments chimiques constitutifs de cette substance dans leur état standard.
Quelle est la différence entre l'enthalpie et l'enthalpie molaire?
L'enthalpie et l'enthalpie molaire sont des termes utiles en chimie physique pour la détermination du contenu thermique total dans un système thermodynamique. La principale différence entre l'enthalpie et l'enthalpie molaire est que l'enthalpie est le contenu thermique total d'un système thermodynamique, tandis que l'enthalpie molaire est la chaleur totale par mole de réactif dans le système. De plus, l'unité de mesure de l'enthalpie est la joules ou les kilojoules, tandis que l'unité de mesure pour l'enthalpie molaire est les kilojoules par mole.
Le tableau suivant résume la différence entre l'enthalpie et l'enthalpie molaire.
Résumé - Enthalpie vs molaire enthalpie
L'enthalpie et l'enthalpie molaire sont des termes utiles qui aident à déterminer le contenu thermique total dans un système thermodynamique. L'enthalpie d'un système est une quantité thermodynamique équivalente au contenu thermique total d'un système. L'enthalpie molaire est la valeur d'enthalpie donnée par mole. Par conséquent, la principale différence entre l'enthalpie et l'enthalpie molaire est que l'enthalpie est le contenu thermique total d'un système thermodynamique, tandis que l'enthalpie molaire est la chaleur totale par mole de réactif dans le système.
Référence:
1. «Enthalpie molaire." Un aperçu | Sujets ScienceDirect, .
2. «Qu'est-ce que l'enthalpie? - Définition, réaction endothermique et exothermique."Byju's, 16 novembre. 2020.
3. «Enthalpie." Chemistry LibreTexts, LibreTexts, 15 août. 2020.
Image gracieuseté:
1. «Enthalpy-diagram-solution-formation-exothermic» par Dale J. Brugh - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


