Quelle est la différence entre l'électrolyte et l'électrolyse
Le différence clé entre l'électrolyte et l'électrolyse Est-ce que l'électrolyte est une substance qui peut produire des ions, tandis que l'électrolyse est un processus dans lequel un courant électrique est utilisé pour entraîner une réaction chimique.
Nous utilisons principalement les termes électrolyte et électrolyse en électrochimie, où nous étudions la relation entre l'électricité et la chimie.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'un électrolyte
3. Qu'est-ce qu'une électrolyse
4. Électrolyte vs électrolyse sous forme tabulaire
5. Résumé - Electrolyte vs électrolyse
Qu'est-ce qu'un électrolyte?
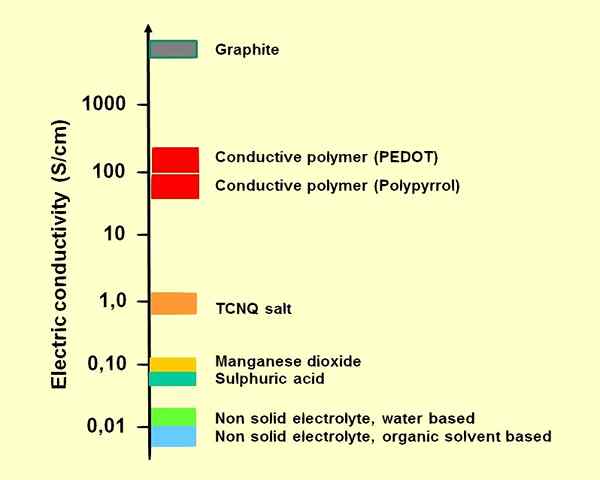
Un électrolyte est une substance qui peut produire des ions. Les électrolytes fournissent des ions lorsqu'ils sont au stade fondu ou lorsqu'ils sont dissous dans un solvant (eau). Ces ions rendent les électrolytes capables de conduire de l'électricité. Cependant, il existe également des électrolytes à l'état solide. De plus, certains gaz comme le dioxyde de carbone produisent des ions (hydrogène et ions bicarbonate) lorsqu'ils se dissolvent dans l'eau.
Nous pouvons classer les électrolytes en deux groupes différents: des électrolytes forts et des électrolytes faibles. Parmi eux, des électrolytes puissants produisent facilement des ions lorsqu'ils sont solubles. Par exemple, les composés ioniques sont des électrolytes forts. Le chlorure de sodium fondu ou les solutions aqueuses NaCl subissent une dissociation complète (en ions Na + et Cl-); Par conséquent, ce sont de bons conducteurs d'électricité. Les acides et les bases forts sont également de bons électrolytes. D'un autre côté, les électrolytes faibles produisent peu d'ions lorsqu'ils sont solubles dans l'eau. De plus, les acides faibles comme l'acide acétique et les bases faibles sont des électrolytes faibles.

Figure 01: Conductivités de certains électrolytes pour les condensateurs électrolytiques
Les électrolytes se produisent également dans le corps. Nous avons besoin de ces électrolytes pour maintenir l'équilibre ionique à l'intérieur des cellules et des liquides sanguins dans un corps sain. L'équilibre électrolytique est très important pour maintenir l'équilibre osmotique et la pression artérielle à l'intérieur du corps. Na +, K + et Ca2 + sont importants dans la transmission des impulsions nerveuses et les contractions musculaires.
Qu'est-ce que l'électrolyse?
L'électrolyse est le processus d'utilisation d'un courant électrique direct pour entraîner une réaction chimique non spontanée. L'électrolyse peut être effectuée en utilisant une cellule électrolytique. Cette technique est très importante pour séparer un composé en ses ions ou autres composants.
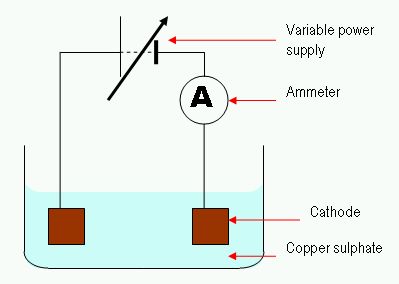
Figure 02: Le processus d'électrolyse simple
Dans le processus d'électrolyse, un courant électrique passe par une solution pour la mobilité des ions dans cette solution. En règle générale, une cellule électrolytique se compose de deux électrodes immergées dans la même solution. Nous appelons cette solution l'électrolyte. Une caractéristique importante dans la régulation de la cellule électrolytique est «sur le potentiel."Nous devons fournir une tension plus élevée afin d'effectuer une réaction non spontanée. Ici, une électrode inerte peut également être utilisée pour fournir la surface de la réaction qui se produit.
Il existe de nombreuses applications utiles de l'électrolyse. Une application courante est l'électrolyse de l'eau. Ici, l'eau est l'électrolyte. Ensuite, la réaction de la dégradation des molécules d'eau en hydrogène et en oxygène est effectuée en utilisant le courant électrique qui est passé à travers l'électrolyte.
Quelle est la différence entre l'électrolyte et l'électrolyse?
La principale différence entre l'électrolyte et l'électrolyse est que l'électrolyte est une substance qui peut produire des ions, tandis que l'électrolyse est un processus dans lequel un courant électrique est utilisé pour entraîner une réaction chimique. En d'autres termes, dans un électrolyte, la substance en fusion ou dissous produit des ions capables de se déplacer à l'état liquide ou dans une solution aqueuse, tandis que dans l'électrolyse, la décomposition d'un électrolyte par un courant électrique se produit. L'électrolyte et l'électrolyse sont liés les uns aux autres de différentes manières. Par exemple, l'électrolyse peut se produire en présence d'un électrolyte.
Résumé - Electrolyte vs électrolyse
Par conséquent, la principale différence entre l'électrolyte et l'électrolyse est que l'électrolyte est une substance qui peut produire des ions, tandis que l'électrolyse est un processus dans lequel un courant électrique est utilisé pour entraîner une réaction chimique. En d'autres termes, les électrolytes sont des substances, tandis que l'électrolyse est un processus.
Référence:
1. Helmenstine, Anne Marie. «Exemples de chimie: électrolytes forts et faibles."Thoughtco, août. 6, 2019.
Image gracieuseté:
1. «CONductivité électrolytes-électriques» par ELCAP - Own Work (CC0) via Commons Wikimedia
2. «Électrolyse Sulfate de cuivre» par Theresa Knott chez les wikibooks anglais. - Transféré de EN.WikiBooks aux communes. (CC BY-SA 3.0) via Commons Wikimedia


