Quelle est la différence entre la diméthylamine et la triméthylamine
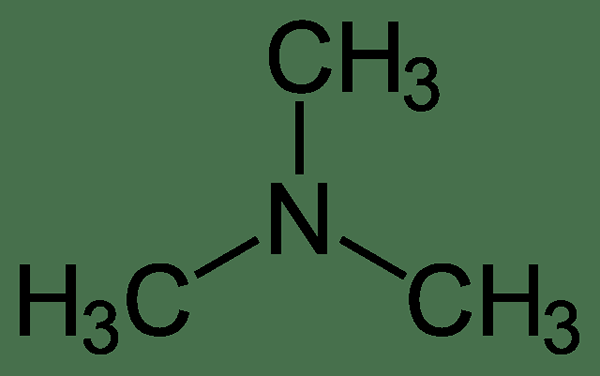
Le différence clé entre la diméthylamine et la triméthylamine est que la diméthylamine contient un atome d'azote central attaché avec deux groupes méthyle au même atome d'azote, tandis que la triméthylamine contient trois groupes méthyle attachés au même atome d'azote.
La diméthylamine et la triméthylamine sont deux composés d'amine importants qui sont utiles dans de nombreuses applications industrielles et de laboratoire différentes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la diméthylamine
3. Qu'est-ce que la triméthylamine
4. Diméthylamine vs groupe triméthylamine sous forme tabulaire
5. Résumé - diméthylamine vs triméthylamine
Qu'est-ce que la diméthylamine?
La diméthylamine est un composé organique ayant la formule chimique (ch3)2NH. Ce composé a deux groupes méthyle attachés au groupe amine. Par conséquent, l'atome d'azote dans le groupe amine n'a qu'un seul atome d'hydrogène qui y est attaché autre que les groupes méthyle. La diméthylamine se produit comme un gaz incolore et a une odeur de poisson. De plus, sa masse molaire est de 45.08 g / mol. Nous le classons comme une amine secondaire à cause des deux groupes méthyle.
Ce composé se produit naturellement dans de nombreuses plantes et animaux. Nous pouvons également produire ce composé via la réaction entre le méthanol et l'ammoniac en présence d'un catalyseur, d'une température élevée et de conditions de pression.
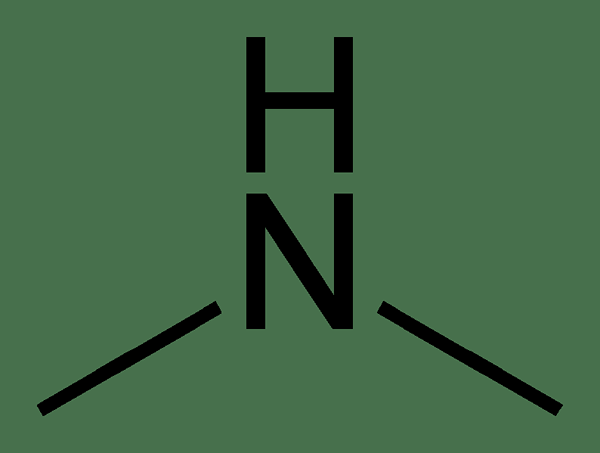
Figure 1: La structure chimique de la diméthylamine
La densité de diméthylamine est 649.6 kg / m3. Le point de fusion de ce composé est de -93 degrés Celsius, tandis que le point d'ébullition peut aller de 7 à 9 degrés Celsius. Il a une mauvaise solubilité dans l'eau. Il peut réagir avec les acides pour former des sels, y compris le chlorhydrate de diméthylamine (qui est un solide blanc sans odor ayant un point de fusion de 171.5 degrés Celsius). Nous pouvons également produire de la diméthylamine à partir de la réaction catalytique du méthanol et de l'ammoniac à des températures élevées et à haute pression.
Qu'est-ce que la triméthylamine?
La triméthylamine est un composé organique ayant la formule chimique N (ch3)3. Ce composé peut être trouvé comme une amine tertiaire incolore, hygroscopique et inflammable qui se produit comme un gaz à température ambiante, mais il est généralement vendu sur le marché comme une solution à 40% dans l'eau. C'est une base azotée qui peut être facilement protonée pour obtenir le cation triméthylammonium.

Figure 02: La structure chimique de la triméthylamine
La molécule de triméthylamine peut être identifiée comme un bon nucléophile. Par conséquent, il est largement utilisé dans de nombreuses applications industrielles. Il est également utile dans la synthèse de la choline, de l'hydroxyde de tétraméthylammonium, des régulateurs de croissance des plantes ou des herbicides, des résines d'échange d'anions fortement basiques, etc. Lorsqu'il est à une concentration élevée, il a une odeur de type ammoniac, et à des concentrations plus faibles, il a une odeur de poisson. À des concentrations plus élevées, il peut provoquer une nécrose des muqueuses au contact.
La masse molaire de ce composé est de 59.112 g / mol. La densité de ce composé est de 670 kg / m3. Le point de fusion de ce composé est -117.20 degrés Celsius, tandis que le point d'ébullition est de 3-7 degrés Celsius. Il est miscible avec l'eau, et la pression de vapeur est de 188.7 kpa à 20 degrés Celsius.
Lorsque vous envisagez la préparation de la triméthylamine, il peut être préparé par la réaction de l'ammoniac et du méthanol avec l'utilisation d'un catalyseur. Cette réaction coproduit également d'autres méthylamines, telles que la diméthylamine et la méthylamine.
Quelle est la différence entre la diméthylamine et la triméthylamine?
La diméthylamine et la triméthylamine sont des composés aminés importants. La différence clé entre la diméthylamine et la triméthylamine est que la diméthylamine contient un atome d'azote central attaché avec deux groupes méthyle au même atome d'azote, tandis que la triméthylamine contient trois groupes méthyle attachés au même atome d'azote.
Comment distinguer la diméthylamine et la triméthylamine?
Lorsque ces deux composés sont mélangés avec le réactif de Hinsberg séparément, la diméthylamine peut produire du n-diméthyl benzène, qui est insoluble dans une solution aqueuse KOH car il a deux groupes méthyle attachés à l'atome d'azote, tandis que la triméthylamine ne réagit pas avec ce réactif car il a trois groupes méthyle attachés au même atome d'azote.
L'infographie ci-dessous présente les différences entre la diméthylamine et la triéthylamine sous forme tabulaire pour une comparaison côte à côte.
Résumé - diméthylamine vs triméthylamine
La différence clé entre la diméthylamine et la triméthylamine est que la diméthylamine contient un atome d'azote central attaché avec deux groupes méthyle au même atome d'azote tandis que la triméthylamine contient trois groupes méthyle attachés au même atome d'azote.
Référence:
1. «Triméthylamine." Centre national d'information sur la biotechnologie. Base de données de composés PubChem, U.S. Bibliothèque nationale de médecine.
Image gracieuseté:
1. «Diméthylamine-2D-squelettique» (domaine public) via Commons Wikimedia
2. «Triméthylamine» par NeuroKer - Propre travaux (domaine public) via Commons Wikimedia


