Quelle est la différence entre l'aspartyl cystéine et la sérine protéases
Le différence clé entre l'aspartyl cystéine et la sérine protéases sont leurs groupes fonctionnels qui agissent comme des résidus catalytiques. Le groupe fonctionnel qui agit comme les résidus catalytiques de l'aspartyl protéase est un groupe d'acide carboxylique, tandis que dans la cystéine protéase, un groupe thiol ou sulfhydryle agit comme le groupe fonctionnel au résidu catalytique, et dans la protéase sérine, un groupe hydroxyle ou un alcool agit En tant que groupe fonctionnel au résidu catalytique.
Les protéases sont des enzymes qui catalysent la protéolyse, qui est la dégradation des protéines en polypeptides plus petits ou acides aminés. Ce processus a lieu en clivant des liaisons peptidiques au sein des protéines par un processus d'hydrolyse. Les protéases sont impliquées dans de nombreuses fonctions biologiques, telles que la digestion des protéines ingérées, le catabolisme des protéines et la signalisation cellulaire. Les protéases sont présentes dans toutes les formes de vie. L'aspartyl, la cystéine et la sérine sont trois protéases importantes qui jouent un rôle clé dans les organismes vivants.
CONTENU
1. Aperçu et différence clé
2. Que sont les protéases aspartyl
3. Que sont les protéases cystéine
4. Que sont les sérine protéases
5. Similitudes - Aspartyl cystéine et sérine protéases
6. Aspartyl vs cystéine vs sérine protéases sous forme tabulaire
7. Résumé -aspartyl vs cystéine vs sérine protéases
Que sont les protéases aspartyl?
Les protéases aspartyl sont un type d'enzymes de rupture des protéines. Ils ont deux aspartates hautement conservés dans le site actif, et ils sont optimalement actifs au pH acide. Ces protéases clivent des liaisons dipeptidiques qui ont des résidus hydrophobes ainsi qu'un groupe bêta-méthylène. Le mécanisme catalytique de l'aspartyl protéase est un mécanisme acide-base. Cela implique la coordination d'une molécule d'eau avec deux résidus aspartate. Un aspartate active la molécule d'eau en éliminant un proton. Cela permet à l'eau d'effectuer une attaque nucléophile sur le carbone carbonyle du substrat. En conséquence, il génère un intermédiaire d'oxyanion tétraédrique qui est stabilisé par des liaisons hydrogène avec le deuxième résidu aspartate. Le réarrangement de cet intermédiaire est responsable du fractionnement du peptide en deux produits peptidiques.
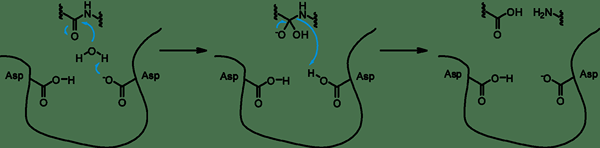
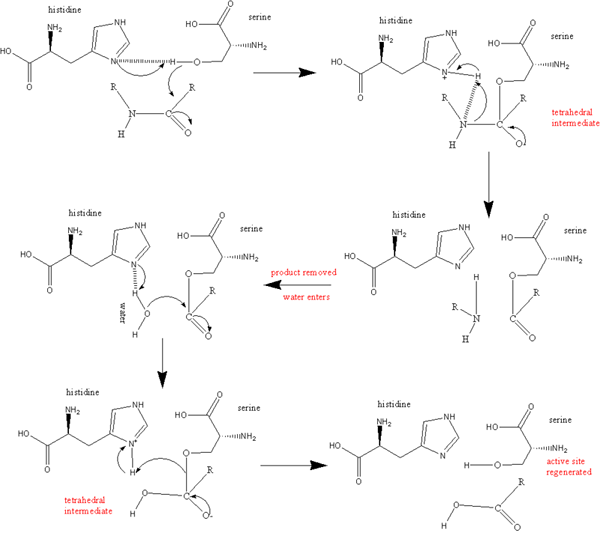
Figure 01: Aspartyl Protease
Il y a cinq superfamilles de protéases aspartiques: clan aa qui est une famille, clan ac, qui est une famille de signal peptidase II, un clan annonce, qui est une famille de préséniline, un clan AE, qui est une famille d'endopeptidase GPR, et Clan AF, qui, qui a été est une famille Omptin.
Que sont les protéases cystéine?
Les cystéine protéases sont un groupe d'enzymes hydrolases qui dégradent les protéines. Ils présentent un mécanisme catalytique qui implique une cystéine thiol nucléophile dans une triade ou une dyade catalytique. L'étape initiale du mécanisme catalytique des protéases de la cystéine est la déprotonation. Le groupe thiol devient déprotoné dans le site actif de l'enzyme par un acide aminé adjacent comme l'histidine, qui a une chaîne latérale de base. L'étape suivante est l'attaque nucléophile par le soufre anionique déprotoné de cystéine sur le substrat. Ici, le fragment du substrat rejette avec une amine, et le résidu d'histidine dans la protéase restaure sa forme déprotonée. Il en résulte la formation de l'intermédiaire thioester du substrat, reliant le nouvel terminus carboxy à la cystéine thiol. La liaison thioester hydrolyse pour générer la fraction acide carboxylique sur le fragment de substrat restant.
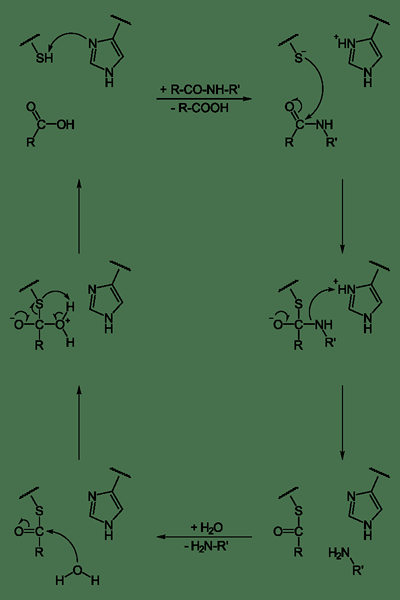
Figure 02: Cystéine Protease
Les protéases cystéine jouent plusieurs rôles dans la physiologie et le développement. Dans les plantes, ils jouent un rôle important dans la croissance, le développement, l'accumulation et la mobilisation des protéines de stockage. Chez l'homme, ils sont importants dans la sénescence et l'apoptose, les réponses immunitaires, le traitement de la prohormone et le remodelage de la matrice extracellulaire au développement du cône.
Que sont les sérine protéases?
Les sérine protéases sont également un groupe d'enzymes protéolytiques qui clivent les liaisons peptidiques dans les protéines. La sérine sert d'acide aminé nucléophile au site actif de l'enzyme. Ceux-ci sont présents dans les eucaryotes et les procaryotes. Les sérine protéases sont généralement divisées en différentes catégories par une structure distinctive qui se compose de deux domaines bêta-baril convergeant sur le site catalytique actif et également basé sur leur spécificité de substrat. Ils sont en forme de trypsine, en forme de chymotrypsine, en forme de thrombine, en forme d'élastase et en forme de subtilisine.

Figure 03: sérine protéase
Les protéases en forme de trypsine clivent des liaisons peptidiques après un acide aminé chargé positivement comme la lysine ou l'arginine. Ils sont spécifiques à des résidus chargés négativement tels que l'acide aspartique ou l'acide glutamique. Les protéases de type chymotrypsine sont plus hydrophobes. Leur spécificité réside dans de grands résidus hydrophobes tels que la tyrosine, le tryptophane et la phénylalanine. Les protéases de type thrombine comprennent la thrombine, qui est un plasminogène activant le tissu et la plasmine. Ceux-ci aident à la coagulation du sang et de la digestion ainsi que dans la physiopathologie des troubles neurodégénératifs. Les protéases de type élastase préfèrent les résidus tels que l'alanine, la glycine et la valine. Les protéases de type subtilisine comprennent la sérine dans les procaryotes. Il partage un mécanisme catalytique en utilisant une triade catalytique afin de créer une sérine nucléophile. La régulation de l'activité de la sérine protéase nécessite une activation initiale de protéase et une sécrétion d'inhibiteurs.
Quelles sont les similitudes entre l'aspartyl cystéine et la sérine protéases?
- L'aspartyl, la cystéine et la sérine protéases catalysent la dégradation des protéines par clivage des liaisons peptidiques.
- Les mécanismes sont similaires lorsque les résidus du site actif attaquent les liaisons peptidiques, ce qui le fait se briser.
- Tous contiennent des nucléophiles.
- Ce sont tous des protéines.
Quelle est la différence entre l'aspartyl cystéine et la sérine protéases?
La principale différence entre l'aspartyl cystéine et la sérine protéases dépend de leur groupe fonctionnel, qui agit comme les résidus catalytiques. Dans l'aspartyl protéase, un groupe d'acide carboxylique agit comme le groupe fonctionnel, tandis que dans la cystéine protéase, un groupe thiol ou sulfhydryle agit comme le groupe fonctionnel, et dans la sérine protéase, un groupe hydroxyle ou un alcool agit comme le groupe fonctionnel.
Les Aspartyl protéases ont un site actif aspartate, tandis que les cystéine protéases ont un site actif de la cystéine. Le résidu du site actif de la sérine protéase est un groupe hydroxyle. Ainsi, c'est aussi une autre différence entre l'aspartyl cystéine et la sérine protéases. Contrairement à la sérine et à la cystéine protéases, les protéases aspartyl ne forment pas un intermédiaire covalent pendant le processus de clivage. Par conséquent, la protéolyse se produit en une seule étape pour les protéases aspartyl.
L'infographie ci-dessous présente les différences entre l'aspartyl cystéine et la sérine protéases sous forme tabulaire pour une comparaison côte à côte.
Résumé - Aspartyl cystéine vs sérine protéases
Les protéases sont des enzymes qui catalysent la dégradation des protéines en polypeptides ou acides aminés plus petits. La principale différence entre l'aspartyl cystéine et la sérine protéases est le groupe fonctionnel qui agit comme leur résidu catalytique. Un groupe d'acide carboxylique agit comme le groupe fonctionnel dans l'aspartyl protéase, tandis qu'un groupe thiol ou sulfhydryle agit comme le groupe fonctionnel de la cystéine protéase. Un groupe hydroxyle ou un alcool agit comme le groupe fonctionnel de la sérine protéase.
Référence:
1. «Mécanismes de protéase.”Sciable, Nature News, Nature Publishing Group.
2. «Protéase cystéine."Science directe.
3. «Sérine protéase."Science directe.
Image gracieuseté:
1. «Mécanisme Aspartyl Protease» par l'anglais Wikipedia User Roadnottaken (CC BY-SA 3.0) via Commons Wikimedia
2. «Cysteinprotease ReaktionsMechanismus» par NeuroKer - Propre travaux (domaine public) via Commons Wikimedia
3. «Mécanisme de sérine protéase par Snellios» par Snellios au Wikipedia en langue anglaise (CC By-SA 3.0) via Commons Wikimedia


