Quelle est la différence entre l'arsenic 3 et l'arsenic 5
Le Différence clé entre l'arsenic 3 et l'arsenic 5 Est-ce que l'arsenic 3 ou l'arsenite est plus toxique que l'arsenic 5 ou l'arsenate.
L'arsenic est souvent considéré comme un élément chimique toxique. Il peut être trouvé dans divers composés différents, en particulier les minéraux. L'arsenic 3 ou l'arsenite est une espèce chimique constituée d'un oxyanion d'arsenic dans lequel l'état d'oxydation de l'arsenic est +3. L'arsenic 5 ou l'arsenate est tout composé chimique ayant de l'oxyanion d'arsenic-5.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'arsenic 3 (arsenite)
3. Qu'est-ce que l'arsenic 5 (arsenate)
4. Arsenic 3 vs arsenic 5 sous forme tabulaire
5. Résumé - Arsenic 3 vs Arsenic 5
Qu'est-ce que l'arsenic 3 (arsenite)?
Arsenic 3 ou arsenite est une espèce chimique composée d'un oxyanion d'arsenic dans lequel l'état d'oxydation de l'arsenic est +3. Le domaine de la chimie des eaux souterraines utilise de l'arsenite comme indication de la présence de l'arsenic 3 dans les eaux souterraines. Selon les guides IUPAC, les composés de l'arsenite sont nommés arsenate (iii), e.g. L'ortho-arsénite est nommée trioxidoarsenate (III). L'ortho-arsénite contient des anions correspondants des membres plus légers du groupe 15, comme le phosphite et le nitrite.
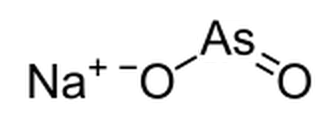
Figure 01: La structure chimique du sel de sodium de l'arsénite
Nous pouvons préparer des sels d'arsénite à partir de la solution aqueuse de As2O3. Par exemple, les sels de méta-arsénite, les sels d'arsénite d'hydrogène, etc. De plus, il existe de nombreux minéraux différents composés d'arsenic 3, comme la Reinerite, le Finnemanite, le Paulmooreite et le Stenhuggarite.
Il existe des utilisations importantes de l'arsenic 3, comme son utilisation dans les réactions de décalage de gaz d'eau pour éliminer le dioxyde de carbone. De plus, certaines espèces bactériennes sont capables d'obtenir de l'énergie en oxydant divers carburants tout en réduisant des arséniats dans la formation d'arsénites. Ce processus est impliqué dans certaines réactions contenant des enzymes appelées arsenate réductases.
Qu'est-ce que l'arsenic 5 (arsenate)?
Arsenic 5 ou arsenate est tout composé chimique ayant de l'oxyanion d'arsenic-5. L'anion arsenate a un atome d'arsenic dans un état d'oxydation +5. Il est également connu sous le nom d'arsenic pentavalent ou comme (v). De plus, l'arsenate ressemble au phosphate à bien des égards car l'arsenic et le phosphore peuvent se produire dans le même groupe du tableau périodique. Les composés de l'arsenic-5 sont des oxydants modérés ayant un potentiel d'électrode de +0.56 V pour la réduction des arsenites.

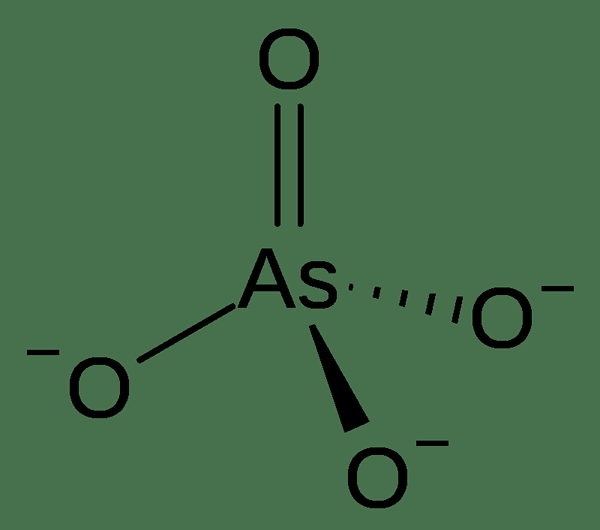
Figure 02: Arsenic-5 Oxyanion
Naturellement, l'arsenic 5 se produit dans des minéraux constitués d'arsénats hydratés ou anhydres. Différentes des phosphates, les arsenates ne se perdent pas d'un minéral pendant le processus d'altération. Par exemple, Adamite, Alarsite, Annabergite, érythrite, etc., contenir l'arsenic 5.
Dans le processus d'intoxication à l'arsenic, l'arséniate peut remplacer le phosphate inorganique dans le cycle de glycolyse, qui donne le 1-arseno-3-phosphoglycérate. Ce composé est instable et hydrolyse rapidement pour former l'intermédiaire suivant dans la même voie. Cela fait passer la glycolyse, mais une molécule ATP n'est pas générée. Cela explique la toxicité de l'arsenic 5.
Quelle est la différence entre l'arsenic 3 et l'arsenic 5?
L'arsenic est un élément chimique important qui est souvent considéré comme toxique. L'arsenic 3 ou l'arsenite est une espèce chimique constituée d'un oxyanion d'arsenic dans lequel l'état d'oxydation de l'arsenic est +3. L'arsenic 5 ou l'arsenate est tout composé chimique ayant de l'oxyanion d'arsenic-5. Les états d'oxydation les plus courants de l'arsenic sont des états d'oxydation de +3 et +5. De plus, la principale différence entre l'arsenic 3 et l'arsenic 5 est que l'arsenic 3 ou l'arsenite est plus toxique que l'arsenic 5 ou l'arsénéate.
L'infographie ci-dessous présente les différences entre l'arsenic 3 et l'arsenic 5 sous forme tabulaire pour une comparaison côte à côte.
Résumé - Arsenic 3 vs Arsenic 5
L'arsenic 3 ou l'arsenite est une espèce chimique constituée d'un oxyanion d'arsenic dans lequel l'état d'oxydation de l'arsenic est +3. L'arsenic 5 ou l'arsenate est tout composé chimique ayant de l'oxyanion d'arsenic-5. La principale différence entre l'arsenic 3 et l'arsenic 5 est que l'arsenic 3 est plus toxique que l'arsenic 5.
Référence:
1. "Arsenic." Wikipédia. Fondation Wikipedia.
2. «Arsenic (3+).«PubChem. NIH - Bibliothèque nationale de médecine, National Center for Biotechnology Information.
Image gracieuseté:
1. «Méta-arsénite de sodium» par Claudio Pistilli - Personnel Travail (CC BY-SA 4.0) via Commons Wikimedia
2. «Arsenate Ion» par Ed (Edgar181) - propre travail (domaine public) via Commons Wikimedia


