Différence entre l'ubiquitination et la sumoylation
Le différence clé entre l'ubiquitination et la sumoylation L'ubiquitination est une modification post-traductionnelle qui peut marquer les protéines pour la dégradation ou avoir d'autres fonctions de célibataire tandis que la sumoylation est une modification post-traductionnelle qui n'est pas utilisée dans les cellules pour marquer les protéines pour la dégradation.
Les modifications post-traductionnelles sont des modifications covalentes et enzymatiques qui se produisent après la synthèse des protéines. Ces modifications régulent les activités protéiques. La fixation des petits groupes chimiques, du sucre, des lipides et des polypeptides modifie les protéines. L'ubiquitine est le modificateur polypeptide le plus connu. De plus, il existe plusieurs protéines de type ubiquitine. Le petit modificateur lié à l'ubiquitine (SUMO) est un de ces modificateurs. Par conséquent, l'ubiquitination et la sumoylation sont deux modifications post-traductionnelles. L'ubiquitination marque les protéines pour la dégradation. En revanche, la sumoylation n'est pas utilisée pour marquer les protéines pour la dégradation. Les deux modifications régulent la localisation et l'activité des protéines. Ce sont des processus réversibles.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'ubiquitination
3. Qu'est-ce que la sumoylation
4. Similitudes entre l'ubiquitination et la sumoylation
5. Comparaison côte à côte - ubiquitination vs sumoylation sous forme tabulaire
6. Résumé
Qu'est-ce que l'ubiquitination?
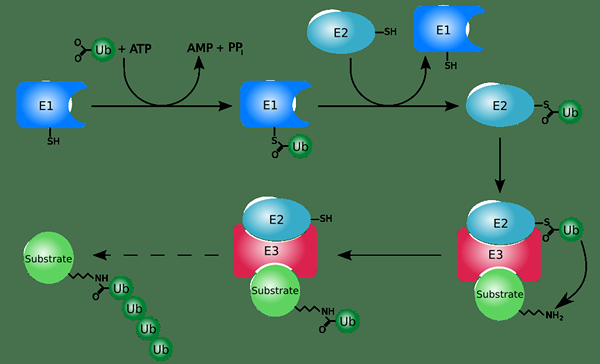
L'ubiquitine est un modificateur polypeptidique. C'est une petite protéine agissant comme une étiquette moléculaire dans la modification post-traductionnelle des protéines. L'ubiquitination est le processus qui utilise l'ubiquitine pour la modification post-traductionnelle. Différentes enzymes catalysent la conjugaison covalente de l'ubiquitine en protéines. Il se déroule en présence d'ATP. Les enzymes qui catalysent l'ubiquitination sont des enzymes activant l'ubiquitine, des enzymes conjuguantes à l'ubiquitine et des ligases d'ubiquitine.

Figure 01: Ubiquitination
L'ubiquitination joue un rôle important dans le ciblage des protéines pour la dégradation protéolytique. De plus, l'ubiquitination peut également réguler la localisation et l'activité des protéines. Ce processus peut être inversé par l'action des enzymes de la deubiquitinase.
Qu'est-ce que la sumoylation?
La sumoylation est une autre modification post-traductionnelle utilisant de petits modificateurs de type ubiquitine (SUMOS). La fixation covalente de sumos modifie la structure et la fonction de la protéine. La sumoylation modifie de manière covalente un grand nombre de protéines impliquées dans de nombreux processus cellulaires, notamment l'expression des gènes, la structure de la chromatine, la transduction du signal et le maintien du génome.
Figure 02: Protéine sumo
La sumoylation régule la localisation et l'activité des protéines similaires à l'ubiquitination. Cependant, contrairement à l'ubiquitination, la sumoylation ne marque pas ou ne marque pas les protéines pour la dégradation. Semblable à l'ubiquitination, la sumoylation est un processus enzymatique qui est catalysé par les enzymes.
Quelles sont les similitudes entre l'ubiquitination et la sumoylation?
- L'ubiquitination et la sumoylation sont deux modifications post-traductionnelles importantes.
- La sumoylation et l'ubiquitination sont des processus réversibles.
- Ils jouent un rôle crucial dans les fonctions biologiques.
- Certaines protéines peuvent être modifiées par sumo et ubiquitine.
- Les deux processus modifient la fonction des protéines.
- De plus, les deux modifications post-traductionnelles régulent la localisation et l'activité des protéines.
- Ils ont besoin d'une cascade d'enzymes.
Quelle est la différence entre l'ubiquitination et la sumoylation?
L'ubiquitination et la sumoylation sont deux modifications post-traductionnelles qui modifient la fonction des protéines. L'ubiquitination est la conjugaison covalente de l'ubiquitine en protéines tandis que la sumoylation est l'ajout de sumos aux protéines. De plus, l'ubiquitination marque des protéines pour la dégradation protéolytique tandis que la sumoylation ne marque pas les protéines pour la dégradation. Ainsi, c'est la principale différence entre l'ubiquitination et la sumoylation.
L'infographie ci-dessous montre plus de détails sur la différence entre l'ubiquitination et la sumoylation.
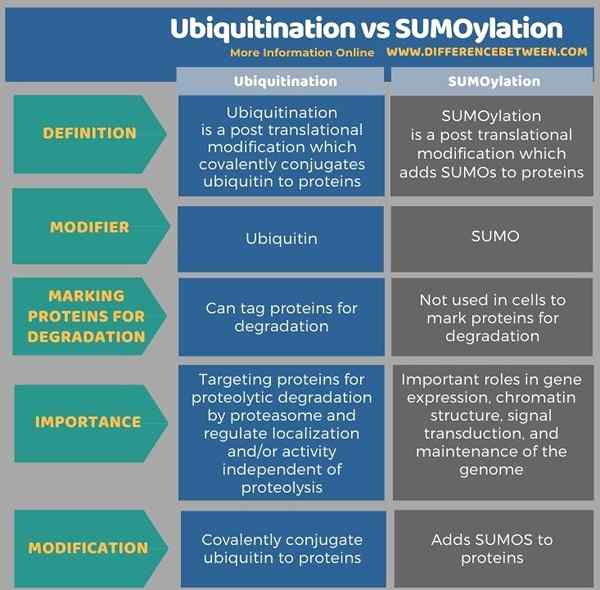
Résumé - Ubiquitination vs sumoylation
L'ubiquitination et la sumoylation sont deux modifications post-traductionnelles importantes. Les deux sont des processus réversibles catalysés par des enzymes. Dans l'ubiquitination, l'ubiquitine est le modificateur polypeptidique tandis qu'en sumoylation, les sumos sont les modificateurs. Les ubiquitines sont conjuguées de manière covalente avec des protéines et modifient leur structure et leur fonction. Les sumos sont ajoutés aux protéines de la sumoylation. La sumoylation est analogue à l'ubiquitylation en termes de schéma de réaction et de classes enzymatiques utilisées. Mais, l'ubiquitination marque les protéines pour la dégradation dépendante du protéasome tandis que la sumoylation n'implique pas dans le marquage des protéines pour la dégradation. Ainsi, c'est la principale différence entre l'ubiquitination et la sumoylation.
Référence:
1. Branchage, grâce. «Sumo et ubiquitine dans le noyau: différentes fonctions, mécanismes similaires?»Genes & Development, Cold Spring Harbor Lab, 1 janvier. 1970, disponible ici.
2. Smith, Yolanda. «Ubiquitination (ubiquitylation).”News, 23 août. 2018, disponible ici.
Image gracieuseté:
1. «Ubiquitylation» par Rogerdodd (CC By-Sa 3.0) via Commons Wikimedia
2. «Ribbons RMR HSUMO1 1A5R» par Jakob Suckale à English Wikipedia - originaire de EN.Wikipedia (domaine public) via Commons Wikimedia


