Différence entre électrolyte vrai et potentiel
Le différence clé entre un électrolyte vrai et potentiel est que Les vrais électrolytes se dissocient complètement en ions tandis que les électrolytes potentiels se dissocient partiellement en ions.
Nous pouvons catégoriser tous les composés en deux groupes sous forme d'électrolytes et de non électrolytes, selon leur capacité à produire des ions et à conduire de l'électricité. L'électrolyse est le processus de passage d'un courant à travers une solution électrolytique et de forcer les ions positifs et négatifs à se déplacer vers leurs électrodes respectives. Les non électrolytes ne peuvent pas participer aux processus d'électrolyse.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le vrai électrolyte
3. Qu'est-ce que l'électrolyte potentiel
4. Comparaison côte à côte - Vrai vs électrolyte potentiel sous forme tabulaire
5. Résumé
Qu'est-ce que le vrai électrolyte?
Les vrais électrolytes sont la substance qui peut se dissocier complètement en ses ions. Ceux-ci sont également nommés comme électrolytes forts. Ces composés produisent facilement leurs formes ioniques lorsqu'ils sont dissous dans l'eau ou une autre solution. Il y a à la fois des cations et des anions dans la solution après la dissociation du composé; Ainsi, ces ions peuvent transporter le courant électrique à travers la solution électrolytique. C'est la raison de son nom «Electrolyte», ce qui signifie «Capacité à conduire l'électricité».
Une solution concentrée d'un véritable électrolyte a une faible pression de vapeur que l'eau pure à une température similaire. Des acides forts, des bases fortes, des sels ioniques solubles qui ne sont pas des acides et des bases faibles peuvent être classés comme véritables électrolytes.

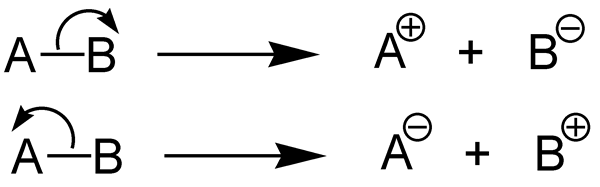
Figure 01: Dissociation complète
Lors de l'écriture de la réaction chimique pour l'ionisation d'un véritable électrolyte, nous pouvons utiliser une seule flèche dans une direction pour montrer la réaction d'ionisation complète contrairement aux électrolytes potentiels ou faibles. Cette seule flèche signifie que la réaction se produit complètement. Les véritables électrolytes ne peuvent conduite de l'électricité que lorsqu'il est en fusion ou à l'état de solutions. Étant donné que l'ionisation est élevée, la tension qu'un véritable électrolyte peut produire est très élevée.
Qu'est-ce que l'électrolyte potentiel?
Les électrolytes potentiels sont les substances qui peuvent se dissocier partiellement en ses ions. Cela signifie qu'il ne peut pas se dissocier complètement dans ses ions dans une solution aqueuse. Par conséquent, la solution aqueuse d'un électrolyte potentiel contiendra à la fois des espèces ioniques et des molécules non dissociées. Habituellement, la dissociation d'un électrolyte potentiel est d'environ 1 à 10%. Ceux-ci sont également nommés électrolytes faibles. Certains exemples courants d'électrolytes faibles incluent l'acide acétique, l'acide carbonique, l'ammoniac, l'acide phosphorique, etc. Ce sont soit des acides faibles ou des bases faibles.
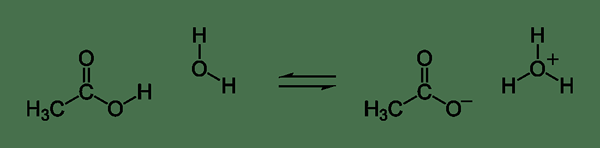
Figure 02: Réaction chimique pour la dissociation de l'acide acétique
Lors de l'écriture de la réaction chimique pour la dissociation d'un électrolyte faible, nous utilisons deux demi-flèches dirigeant vers des directions opposées. Cette flèche signifie qu'il existe un équilibre entre les espèces ioniques et les molécules syndiquées dans la solution aqueuse.
Quelle est la différence entre l'électrolyte vrai et potentiel?
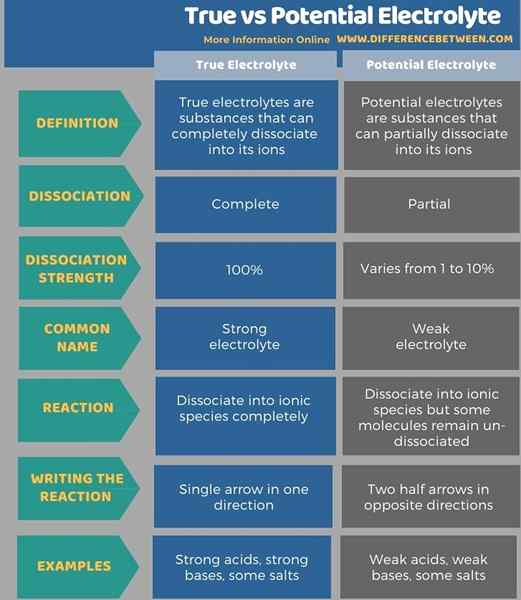
Selon leur capacité à produire des ions et à conduire de l'électricité, nous pouvons classer tous les composés en deux groupes sous forme d'électrolytes et non électrolytes. Les électrolytes sont à nouveau divisés en deux parties en tant qu'électrolytes vrais et potentiels. La principale différence entre l'électrolyte vrai et potentiel est que les vrais électrolytes se dissocient complètement en ions tandis que les électrolytes potentiels se dissocient en partie. De plus, la force de dissociation des véritables électrolytes est de 100% tandis que la résistance à la dissociation des électrolytes potentiels varie de 1 à 10%.
Le tableau suivant résume la différence entre l'électrolyte vrai et potentiel.
Résumé - Vrai vs Electrolyte potentiel
Les vrais électrolytes sont la substance qui peut se dissocier complètement en ses ions tandis que les électrolytes potentiels sont les substances qui peuvent se dissocier partiellement en ses ions. Par conséquent, la principale différence entre l'électrolyte vrai et potentiel est que les véritables électrolytes se dissocient complètement en ions, tandis que les électrolytes potentiels se dissocient en partie des ions.
Référence:
1. Helmenstine, Todd. «Définition et exemples et exemples de l'électrolyte faible."Thoughtco, février. 11, 2020, disponible ici.
Image gracieuseté:
1. «Hétérolyse (chimie)» par Jürgen Martens (CC BY-SA 3.0) via Commons Wikimedia
2. «Acétique-acide-disciation-2d» par Ben Mills - propre travail (domaine public) via Commons Wikimedia