Différence entre le titration et la neutralisation

Le différence clé entre le titration et la neutralisation est que Le titrage est une technique analytique, tandis que la neutralisation est une réaction chimique.
Le titrage et la neutralisation sont des termes très importants en chimie. Le titrage est une technique qui nécessite un appareil spécifique, et il se déroule sur la base d'une réaction de neutralisation. Les réactions de neutralisation sont des réactions chimiques où l'acidité est équilibrée par l'ajout d'une base ou vice versa pour obtenir une solution neutre.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le titrage
3. Qu'est-ce que la neutralisation
4. Comparaison côte à côte - titration vs neutralisation sous forme tabulaire
5. Résumé
Qu'est-ce que le titrage?
Le titration est une technique analytique utile pour mesurer la concentration d'une certaine solution chimique. Nous pouvons le faire en utilisant une solution qui a une concentration connue. Un processus de titrage nécessite un appareil spécifique.
Dans un appareil de titration, il existe une bureautte qui contient généralement une solution standard avec une concentration connue. Si la solution dans la bureautte n'est pas une solution standard, elle doit être standardisée en utilisant une norme primaire. Le ballon de titrage est rempli d'un échantillon en constituant un composant chimique avec une concentration inconnue. Si la solution standardisée (dans Burerette) ne peut pas agir comme un auto-indicateur, nous devons ajouter un indicateur approprié à l'échantillon dans le ballon de titrage.
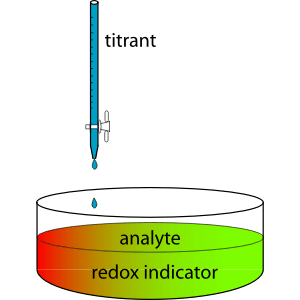
Figure 01: Une réaction de titrage
Pendant le processus de titration, la solution standardisée est ajoutée au ballon lentement jusqu'à ce qu'un changement de couleur se produit. Le changement de couleur de la solution d'analyte indique le point final du titrage. Bien que ce ne soit pas le point exact auquel se termine le titrage, nous pouvons supposer que c'est le point d'équivalence car il n'y a qu'une légère différence (le point d'équivalence est le point où la réaction s'arrête réellement).
La lecture de la bureautte est utile pour déterminer la quantité de solution standard qui a réagi avec l'échantillon. Ensuite, en utilisant des réactions chimiques et des relations stœchiométriques, nous pouvons calculer la concentration de l'inconnu.
Qu'est-ce que la neutralisation?
Le terme neutralisation fait référence à une réaction chimique entre un acide et une base, qui produit une solution neutre. Le pH d'une solution neutre est pH = 7. La réaction de neutralisation implique la combinaison de H+ ions et oh- ions pour former des molécules d'eau.

Figure 02: Neutralisation de l'hydroxyde de sodium et de l'acide chlorhydrique
Si le pH final d'un mélange réactionnel acide et de base est de 7, cela signifie des quantités égales de H+ et oh- Les ions ont réagi dans cette réaction (afin de former une molécule d'eau+ ion réagit avec un oh- ion). Les acides et les bases réagis peuvent être solides ou faibles. Selon la nature de l'acide et de la base, il existe plusieurs types de réactions de neutralisation comme suit:
- Forte réaction de base acide
- Forte réaction de base de la feme-acide
- Réaction de base de la faiblesse acide
- Réaction de base à faible acide
Parmi ces quatre types, seule la réaction entre les acides forts et les bases fortes donne une solution neutralisée ayant exactement un pH = 7. D'autres réactions donnent des solutions neutralisées avec des valeurs de pH variables en raison de la variation du pH de l'acide / base.
Quelle est la différence entre le titration et la neutralisation?
Le titrage et la neutralisation sont des termes très importants en chimie. Le titrage est une technique qui nécessite un appareil spécifique, et il se déroule sur la base d'une réaction de neutralisation. La principale différence entre le titrage et la neutralisation est que le titrage est une technique analytique, tandis que la neutralisation est une réaction chimique.
L'infographie ci-dessous compare la différence entre le titration et la neutralisation sous forme tabulaire.
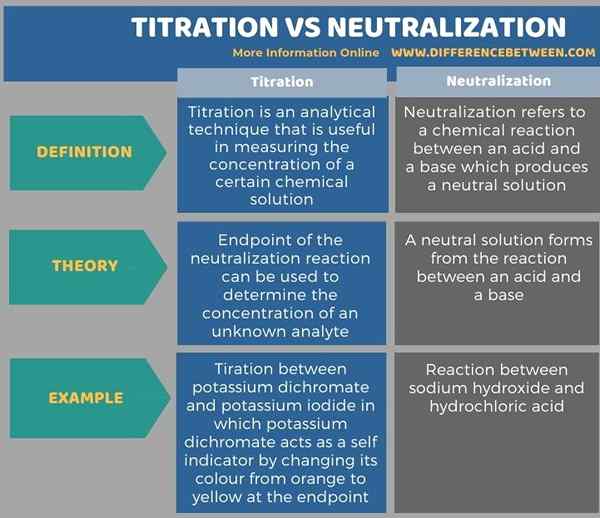
Résumé - titration vs neutralisation
Le titrage et la neutralisation sont des termes très importants en chimie. Le titrage est une technique qui nécessite un appareil spécifique, et il se déroule sur la base d'une réaction de neutralisation. La principale différence entre le titrage et la neutralisation est que le titrage est une technique analytique, tandis que la neutralisation est une réaction chimique.
Référence:
1. "Titrage.”Chemistry LibreTexts, LibreTexts, 23 juin 2019, disponible ici.
Image gracieuseté:
1. «Redox titration Using Indicator» (CC0) via SVG gratuit
2. «Réaction de neutralisation entre l'hydroxyde de sodium et l'acide chlorhydrique» par bluescan sv.Wiki - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


