Différence entre Thomson et Rutherford Model of Atom

Différence clé - Modèle d'atome de Thomson vs Rutherford
La principale différence entre Thomson et Rutherford Model of Atom est que Le modèle Thomson de l'atome ne contient aucun détail sur le noyau alors que Le modèle d'atome de Rutherford explique le noyau d'un atome. J.J. Thomson a été le premier à découvrir la particule subatomique appelée électron en 1904. Le modèle qu'il a proposé a été nommé «modèle de pudding prune de l'atome». Mais en 1911, Ernest Rutherford a proposé un nouveau modèle pour l'atome après sa découverte du noyau atomique en 1909.
CONTENU
1. Aperçu et différence clé
2. Quel est le modèle Thomson de l'atome
3. Quel est le modèle d'atome Rutherford
4. Comparaison côte à côte - Modèle Thomson vs Rutherford de l'atome sous forme tabulaire
5. Résumé
Quel est le modèle Thomson de l'atome?
Le modèle Thomson de l'atome est appelé Modèle de pudding prune Parce qu'il indique que l'atome ressemble à un pudding prune. Les seuls détails connus sur l'atome à l'époque étaient,
- Les atomes sont composés d'électrons
- Les électrons sont des particules chargées négativement
- Les atomes sont chargés de manière neutre
Étant donné que les électrons sont chargés négativement, Thomson a suggéré qu'il devrait y avoir une charge positive afin de neutraliser la charge électrique de l'atome. Le modèle Thomson de l'atome explique que les électrons sont intégrés dans un matériau solide chargé positivement qui est de forme sphérique. Cette structure ressemble à un pudding avec des prunes intégrées et a été nommée modèle de pudding de prune d'atome. Cela a prouvé l'hypothèse selon laquelle un atome est chargé de manière neutre car ce modèle déclare que les charges négatives des électrons sont neutralisées par la charge positive de la sphère solide. Bien que ce modèle ait prouvé que les atomes sont chargés de manière neutre, il a été rejeté après la découverte du noyau.

Figure 01: Modèle Thomson de l'atome
Quel est le modèle d'atome Rutherford?
Selon le modèle d'atome de Rutherford, le modèle soi-disant Plum Pudding de Thomson était incorrect. Le modèle d'atome de Rutherford est également appelé modèle nucléaire car il fournit des détails sur le noyau d'un atome.
La célèbre expérience appelée «Rutherford Gold Foil Experiment» a conduit à la découverte du noyau. Dans cette expérience, les particules alpha ont été bombardées à travers une feuille d'or; On s'attendait à ce qu'ils passent directement à travers la feuille d'or. Mais au lieu d'une pénétration droite, les particules alpha se sont transformées en directions différentes.
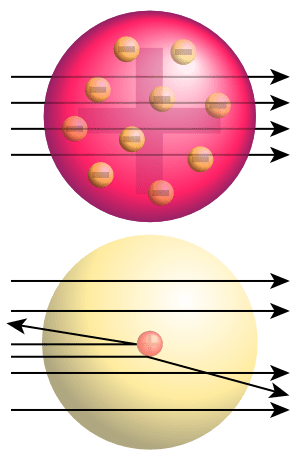
Figure 02: Expérience en feuille d'or Rutherford Haut: Résultats attendus (pénétration droite) Bas: Résultats observés (déviation de certaines particules)
Cela a indiqué qu'il y a quelque chose de solide avec une charge positive dans cette feuille d'or qui provoque une collision avec des particules alpha. Rutherford a nommé ce noyau positif comme le noyau. Il a ensuite suggéré le modèle nucléaire pour l'atome; Il était composé d'un noyau chargé positivement et d'électrons chargés négativement entourant le noyau. Il a également suggéré que les électrons sont en orbitales autour du noyau à certaines distances. Ce modèle est également appelé modèle planétaire Parce que Rutherford a suggéré que les électrons sont situés autour du noyau similaire aux planètes situées autour du soleil.
Selon ce modèle,
- L'atome est composé d'un centre chargé positivement qui est appelé le noyau. Ce centre contenait la masse de l'atome.
- Les électrons sont situés à l'extérieur du noyau en orbitales à une distance considérable.
- Le nombre d'électrons est égal au nombre de charges positives (plus tard appelées protons) dans le noyau.
- Le volume du noyau est négligeable par rapport au volume de l'atome. Par conséquent, la plupart de l'espace de l'atome est vide.
Cependant, ce modèle d'atome de Rutherford a également été rejeté car il ne pouvait pas expliquer pourquoi les électrons et les charges positives dans le noyau ne sont pas attirées les unes contre les autres.

Figure 03: Modèle de Rutherford de l'atome
Quelle est la différence entre Thomson et Rutherford Model of Atom?
Modèle Thomson vs Rutherford de l'atome | |
| Le modèle d'atome Thomson est le modèle qui indique que les électrons sont intégrés dans un matériau solide chargé positivement qui est de forme sphérique. | Le modèle d'atome de Rutherford est le modèle qui explique qu'il y a un noyau au centre de l'atome et des électrons sont situés autour du noyau. |
| Noyau | |
| Le modèle d'atome Thomson ne donne aucun détail sur le noyau. | Le modèle d'atome de Rutherford fournit des détails sur le noyau d'un atome et son emplacement à l'intérieur de l'atome. |
| Emplacement des électrons | |
| Selon le modèle de Thomson de l'atome, les électrons sont intégrés dans un matériau solide. | Le modèle Rutherford dit que les électrons sont situés autour du noyau. |
| Orbitales | |
| Le modèle Thomson de l'atome ne donne pas de détails sur les orbitales. | Rutherford Model of Atom explique les orbitales et que les électrons sont situés dans ces orbitales. |
| Masse | |
| Le modèle de Thomson de l'atome explique que la masse d'un atome est la masse de solide chargé positivement où les électrons sont intégrés. | Selon le modèle de Rutherford de l'atome, la masse d'un atome est concentrée dans le noyau de l'atome. |
Résumé - Modèles de l'atome de Thomson vs Rutherford
Les modèles d'atome de Thomson et Rutherford ont été les premiers modèles à expliquer la structure d'un atome. Après la découverte de l'électron par J.J. Thomson, il a proposé un modèle pour expliquer la structure de l'atome. Plus tard, Rutherford a découvert le noyau et a introduit un nouveau modèle utilisant à la fois l'électron et le noyau. La principale différence entre Thomson et Rutherford Model of Atome est que le modèle Thomson d'atome ne contient aucun détail sur le noyau tandis que le modèle d'atome de Rutherford explique le noyau de l'atome.
Télécharger la version PDF de Thomson vs Rutherford Modèles d'ATOM
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon les notes de citation. Veuillez télécharger la version PDF ici différence entre Thomson et Rutherford Model of Atom.
Référence:
1.”Rutherford Modèle de l'atome: définition et diagramme." Étude.com. n.d. la toile. Disponible ici. 06 juin 2017.
2. Brescia, Frank. Fondamentaux de la chimie: une introduction moderne (1966). Elsevier, 2012. Imprimer.
3. Goldsby, Kenneth. Chimie. 12 ed. New York: McGraw-Hill, 2015. Imprimer.
Image gracieuseté:
1. «Plum Pudding Atom» (domaine public) via Commons Wikimedia
2. «Rutherford Atom» par son propre travail (CreateJoder XD XD) (CC BY-SA 3.0) via Commons Wikimedia
3. «Résultats de l'expérience en feuille d'or de Rutherford» par l'utilisateur: FastFission propre travail (domaine public) via Commons Wikimedia


