Différence entre les vides tétraédriques et octaédriques
Différence clé - vides tétraédriques vs octaédriques
Lorsque vous envisagez des substances inorganiques étroitement emballées, il existe des espaces vides qui sont appelés vides. Les vides sont inoccupés et des espaces vides de cellules unitaires en substances inorganiques. Une cellule unitaire est une unité fondamentale qui montre la disposition chimique de la substance entière qui est composée d'unités répétitives. Les atomes, les molécules ou les ions dont le système cristallin est généralement appelé sphère. Dans les substances solides étroitement emballées, il existe deux types de vides qui peuvent être observés; vides tétraédriques et vides octaédriques. Le différence clé entre le vide tétraédrique et octaédrique est que Les vides tétraédriques sont visibles dans des substances ayant des systèmes cristallins tétraédriques tandis que les vides octaédriques sont visibles dans des substances ayant des systèmes cristallins octaédriques.
CONTENU
1. Aperçu et différence clé
2. Que sont les vides tétraédriques
3. Que sont les vides octaédriques
4. Similitudes entre les vides tétraédriques et octaédriques
5. Comparaison côte à côte - vides tétraédriques vs octaédriques sous forme tabulaire
6. Résumé
Que sont les vides tétraédriques?
Les vides tétraédriques sont inoccupés, des espaces vides présents dans des substances ayant des systèmes de cristal tétraédriques. Par conséquent, ce vide se produit entre quatre constituants. Un vide tétraédrique est formé lorsqu'un atome (ou une sphère) est placé sous dépression formé par trois autres atomes (ou sphères). Par conséquent, deux couches atomiques sont impliquées dans la formation d'un vide tétraédrique.
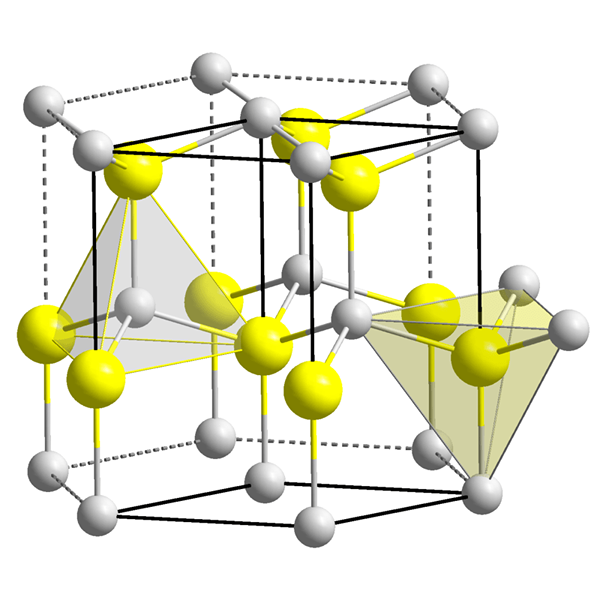
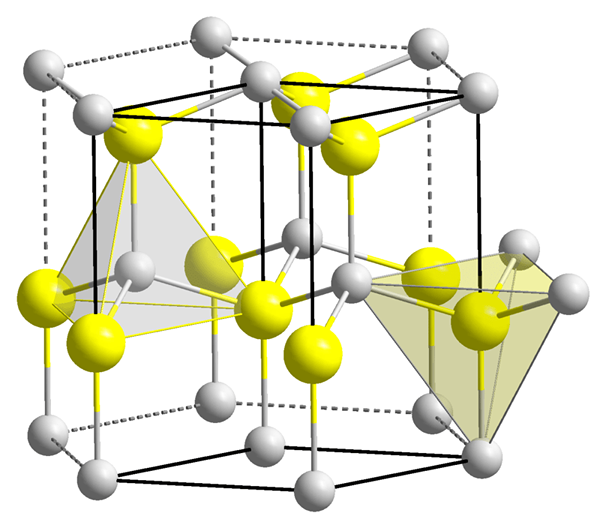
Figure 1: Deux vides tétraédriques.
Cependant, la forme du vide tétraédrique n'est pas tétraédrique, seule la disposition de quatre particules autour du vide est tétraédrique. Les formes des vides sont très compliquées. Le volume d'un vide tétraédrique est beaucoup plus petit que celui d'un atome (ou de sphère) qui provoque la formation du vide. Plus grand de la taille des particules autour du vide, plus grande de la taille du vide. Le numéro de coordination du vide tétraédrique est de quatre. Ici, le terme numéro de coordination représente le nombre d'atomes ou d'ions entourant immédiatement le vide. Dans le système cristallin, il y a deux vides par sphère (atome). Ces vides et leurs tailles ont une grande influence sur les propriétés des matériaux.
Que sont les vides octaédriques?
Les vides octaédriques sont inoccupés, des espaces vides présents dans des substances ayant des systèmes cristallins octaédriques. Un vide octaédrique se forme entre six atomes (ou sphères). Là, trois atomes (ou sphères) étroitement emballés forment un triangle équilatéral et sont placés sur les trois autres atomes, provoquant une forme de vide. Ici, deux couches atomiques sont également impliquées dans la formation du vide.
Figure 2: Un vide octaédrique au centre de la cellule unitaire.
Le volume d'un vide octaédrique est très petit par rapport à un vide tétraédrique. Lorsqu'une cellule unitaire d'une substance (ayant un arrangement octaédrique) est considérée, il y a un vide octaédrique au centre de la cellule unitaire, et le nombre de coordination de ce vide est de six car six atomes l'entourent. Dans un réseau cristallin, il y a un vide pour une sphère (ou atome).
Quelles sont les similitudes entre les vides tétraédriques et octaédriques?
- Les deux sont des vides présents dans les réseaux cristallins.
- Les deux sont plus petits que les sphères qui accumulent le réseau de cristal.
Quelle est la différence entre les vides tétraédriques et octaédriques?
Vide tétraédrique vs vide octaédrique | |
| Les vides tétraédriques sont inoccupés, des espaces vides présents dans des substances ayant des systèmes de cristal tétraédriques. | Les vides octaédriques sont inoccupés, des espaces vides présents dans des substances ayant des systèmes cristallins octaédriques. |
| Système cristallin | |
| Des vides tétraédriques peuvent être trouvés dans des substances ayant un arrangement tétraédrique dans leur système cristallin. | Des vides octaédriques peuvent être trouvés dans des substances ayant un arrangement octaédrique dans leur système cristallin. |
| Emplacement dans la cellule unitaire | |
| Des vides tétraédriques peuvent être observés dans les bords de la cellule unitaire. | Des vides octaédriques peuvent être observés au centre de la cellule unitaire. |
| Numéro de coordination | |
| Le numéro de coordination du vide tétraédrique est de quatre. | Le numéro de coordination du vide octaédrique est de six. |
| Nombre de vides dans le réseau cristallin | |
| Il y a deux vides tétraédriques par sphère dans le réseau cristallin. | Il y a un vide octaédrique par sphère dans le réseau cristallin. |
Résumé - Vides tétraédriques vs octaédriques
Les vides sont des espaces vides présents dans les systèmes cristallins qui surviennent en raison des différents arrangements d'atomes. Il existe deux principaux types de vides nommés vide tétraédrique et vide octaédrique. La différence entre les vides tétraédriques et octaédriques est que le vide tétraédrique est visible dans des substances ayant des systèmes cristallins tétraédriques tandis que le vide octaédrique est visible dans des substances ayant des systèmes cristallins octaédriques.
Téléchargez les vides PDF Tetraheddral vs octaédriques
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon la note de citation. Veuillez télécharger la version PDF ici différence entre les vides tétraédriques et octaédriques
Référence:
1.Maramandansubu suivez. «Voids dans les cristaux.»LinkedIn Slideshare, 16 juin 2013. Disponible ici
2.«Vide tétraédrique et vide octaédrique.»Studylayer.com, 12 mars. 2016. Disponible ici
Image gracieuseté;
1.'Wurtzite Polyhedra'By Solid State - Propre travaux, (domaine public) via Commons Wikimedia
2.'Octaédrique Crystal Field'By P.vermer - propre travail, (cc by-sa 3.0) via Commons Wikimedia


