Différence entre Syn et Anti Addition

Différence clé - Syn vs anti-ajout
En chimie organique, les réactions d'addition sont caractérisées par deux groupes qui se lient à une double liaison. Au cours de cette réaction d'addition caractéristique des alcènes, la liaison P de la double liaison est cassée et de nouvelles liaisons σ sont formées. C'est parce que la liaison p de la liaison c = c est beaucoup plus faible et instable que la liaison C-C σ. De plus, la liaison P des alcènes les rend riches en électrons, car la densité électronique de P est concentrée au-dessus et en dessous du plan de la molécule. Par conséquent, la liaison P est plus vulnérable aux électrophiles σ que la liaison. La stéréochimie est importante pour déterminer le mécanisme des réactions d'addition. La stéréochimie des réactions d'addition dépend de deux aspects. Le premier est le côté de jonction de l'électrophile et du nucléophile aux carbones à double liaison (que ce soit du même côté de la double liaison ou du côté opposé). Le deuxième aspect est l'orientation géométrique des électrophiles et des nucléophiles les uns aux autres et le reste de la molécule organique. Sur la base de ces aspects, il y a deux stéréochimités possibles pour l'ajout, SYN et Anti. Le différence clé Entre l'addition syn et l'anti-ajout est que En ajout syn, les électrophiles et les nucléophiles s'ajoutent du même côté du plan d'atomes de carbone à double liaison, tandis que dans l'anti-addition, les nucléophiles et les électrophiles s'ajoutent des côtés opposés de ce plan. De plus amples détails liés aux syn et anti-ajouts sont discutés ci-dessous.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que Syn Ajout
3. Qu'est-ce que l'anti-ajout
4. Comparaison côte à côte - Syn vs anti-ajout sous forme tabulaire
5. Résumé
Qu'est-ce que Syn Ajout?
L'ajout de syn est une stéréochimie possible de l'addition où se lient à la fois électrophile et nucléophile du même côté du plan des atomes de carbone à double liaison d'un alcène. L'ajout Syn se produit souvent lorsque les alcènes ont un substituant aryle.
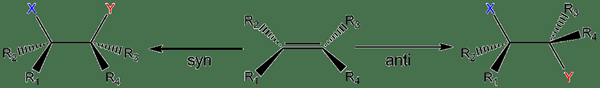
Figure 01: Syn et anti-ajout
De plus, il se produit dans l'hydroboration. Pendant l'hydrohalogénation et l'hydratation, SYN et anti-ajout peuvent se produire. Pendant l'hydroboration, la première étape est la formation d'un alkylborane intermédiaire par l'ajout de H et BH2 à la liaison p d'un alcène. Puis dans la deuxième étape, H-BH2 et la liaison P est brisée pour former de nouvelles liaisons σ. L'état de transition de cette réaction est à quatre centres à mesure que quatre atomes sont impliqués pour former l'intermédiaire.
Qu'est-ce que l'anti-ajout?
L'anti-addition est une stéréochimie possible de l'addition où l'électrophile et les nucléophiles se lient aux côtés opposés du plan des atomes de carbone à double liaison d'un alcène. Anti-ajout se produit dans la formation d'halogénation et de halohydrine. L'halogénation est l'ajout de x2 (où x = br ou cl). L'halogénation des alcènes a deux étapes.
Dans la première étape, l'ajout de l'électrophile (x+) à la liaison P a eu lieu. Au cours de cette étape, un anneau à trois membres avec un atome d'halogène chargé positivement appelé ion halonium ponté. La première étape est l'étape de détermination du taux. Puis dans la deuxième étape, une attaque nucléophile de x- se déroule. Pendant cette étape, x-Attaque l'anneau d'ion de halonium l'ouvre puis forme la liaison C-X nouvelle σ.
Quelle est la différence entre Syn et Anti Addition?
Syn Addition vs anti-ajout | |
| L'ajout de syn est une stéréochimie possible de l'addition où se lient à la fois électrophile et nucléophile du même côté du plan des atomes de carbone à double liaison d'un alcène. | L'anti-addition est une stéréochimie possible de l'addition où l'électrophile et les nucléophiles se lient aux côtés opposés du plan des atomes de carbone à double liaison d'un alcène |
| Réactions d'addition | |
| Hydroboration, hydrohalogénation et hydratation | Halogénation, formation de halohydrine, hydrohalogénation et hydratation |
Résumé - Syn vs anti-ajout
Les alcènes sont caractérisés par les réactions d'addition, qui sont classées en deux types en fonction de la stéréochimie; Syn Addition et anti-ajout. Pendant l'addition, la liaison P de C = C se casse pour former une nouvelle liaison σ. En ajout syn, les liaisons nucléophiles et électrophiles du même côté du plan de la liaison p de la liaison C = C de l'alcène, alors que dans l'anti-addition, les nucléophiles et les électrophiles s'ajoutent au côté opposé du plan de la liaison P. C'est la différence entre SYN et anti-ajouts.
Téléchargez la version PDF de Syn vs anti-ajout
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon la note de citation. Veuillez télécharger la version PDF ici la différence entre SYN et Anti Addition
Référence:
- Libby, R. D. (1999). Chimie organique (par Joseph M. Hornback). Journal of Chemical Education, 76, 611.
- Smith, J.g. (2008), Organic Chemistry, 3rd McGraw-Hill, NY.
- Sangal, un. (2010). La chimie organique avancée de Krishna; Volume 1.Krishna Prakashan Media.
Image gracieuseté:
- 'Syn Anti' (domaine public) via les communes Wikimedia


