Différence entre sulfonate et sulfate
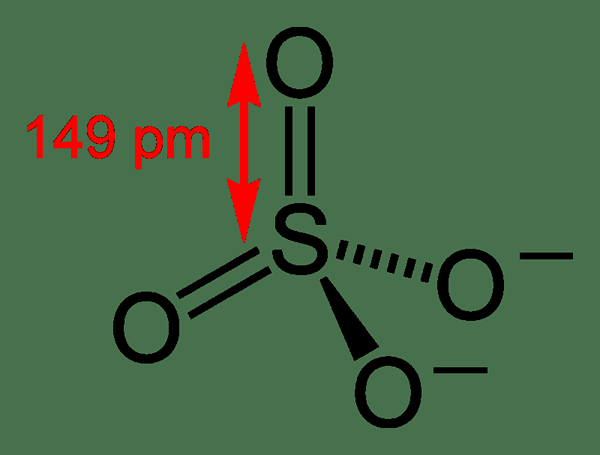
Le différence clé entre le sulfonate et le sulfate est que Le sulfonate est un anion qui se forme à partir de l'acide sulfonique, tandis que le sulfate est un anion qui se forme à partir de l'acide sulfurique.
Bien que les termes sulfonate et sulfate semblent similaires, ce sont des anions complètement différents. Si nous regardons leur structure chimique, le sulfonate a un groupe R, qui est un groupe organique, tandis que le sulfate n'a pas de groupes R.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le sulfonate
3. Qu'est-ce que le sulfate
4. Comparaison côte à côte - sulfonate vs sulfate sous forme tabulaire
6. Résumé
Qu'est-ce que le sulfonate?
Le sulfonate est un anion qui a la formule chimique R-SO3-. Ici, le groupe R est un groupe organique. Et, cet anion provient de l'acide sulfonique. Généralement, ces anions sont stables dans l'eau et sont incolores en solution aqueuse. De plus, ces anions ne sont pas oxydés. La structure chimique est la suivante: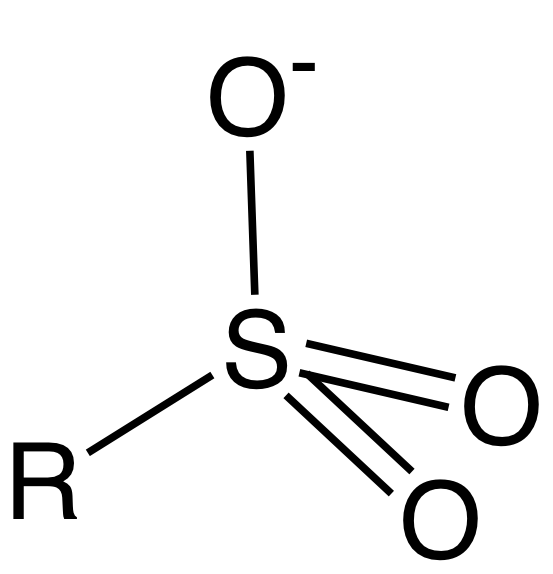
Les acides sulfoniques sont des acides forts. Étant donné que le sulfonate est la base conjuguée de l'acide sulfonique, le sulfonate est une base faible. L'état d'oxydation de l'atome de soufre dans cet anion est de +5, et la charge globale est -1. Semblable à l'anion sulfate, cet anion a également deux liaisons S = O mais a une liaison R-S et une liaison S-O comme liaisons simples (l'anion sulfate a deux liaisons si simples).
Qu'est-ce que le sulfate?
Le sulfate est un anion ayant la formule chimique donc4−2. Il provient de l'acide sulfurique. Et, cet anion a quatre atomes d'oxygène attachés à l'atome du soufre central, et l'anion a une géométrie tétraédrique. L'atome de soufre a un état d'oxydation de +6. Il y a deux atomes d'oxygène avec -1 charge.

Figure 02: Structure de l'anion sulfate
Nous pouvons produire cet anion en utilisant deux méthodes principales:
- Traiter un métal ou un oxyde métallique avec de l'acide sulfurique
- Oxydation des sulfures de métal en sulfites
À quelques exceptions près que le sulfate de calcium et le sulfate de strontium, tous les autres composés sulfate sont connus pour être solubles dans l'eau. De plus, cet anion peut servir de ligand dans les composés de coordination en se fixant avec un atome d'oxygène (ligand monodentate) ou deux (ligand bidenté).
Quelle est la différence entre le sulfonate et le sulfate?
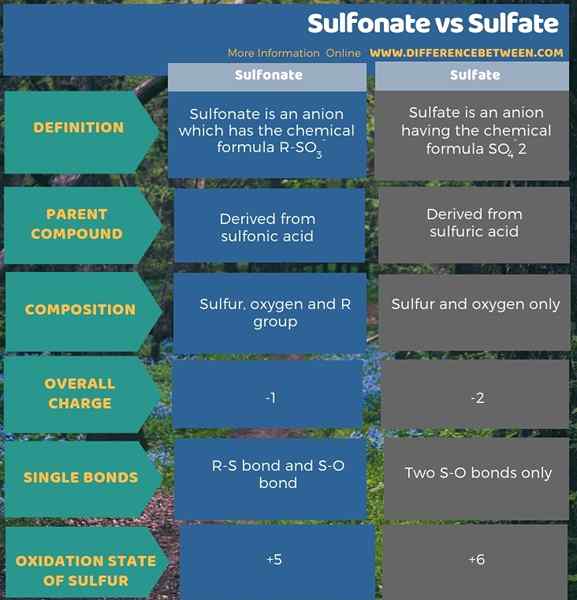
Le sulfonate est un anion qui a la formule chimique R-SO3- tandis que le sulfate est un anion ayant la formule chimique donc4−2. La principale différence entre le sulfonate et le sulfate est que le sulfonate est un anion qui se forme à partir de l'acide sulfonique, tandis que le sulfate est un anion qui se forme à partir de l'acide sulfurique.
De plus, l'état d'oxydation de l'atome de soufre dans le sulfonate est de +5, et en sulfate, il est +6. En dehors de cela, la charge globale de l'anion sulfonate est de -1, et dans l'anion sulfate, il est de -2. C'est donc aussi une différence entre le sulfonate et le sulfate.
Résumé - sulfonate vs sulfate
Le sulfonate est un anion qui a la formule chimique R-SO3- tandis que le sulfate est un anion ayant la formule chimique donc4−2. La principale différence entre le sulfonate et le sulfate est que le sulfonate est un anion qui se forme à partir de l'acide sulfonique, tandis que le sulfate est un anion qui se forme à partir de l'acide sulfurique.
Référence:
1. Deziel, Chris. «Qu'est-ce que le sulfate?»Science, 2 mars. 2019, disponible ici.
Image gracieuseté:
1. «SulfonateTet» par Smokefoot - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Sulfate-ion-2d-dimensions» par Benjah-BMM27 - propre travail (domaine public) via Commons Wikimedia


