Différence entre la sublimation et le dépôt

Le différence clé entre la sublimation et le dépôt est que La sublimation est le changement d'une substance solide en une substance gazeuse sans passer par une phase liquide tandis que le dépôt est le changement d'une substance d'une phase gazeuse à une phase solide sans passer l'état liquide.
La transition de phase se réfère à la modification des phases d'une substance. Des facteurs externes tels que les changements de température et de pression affectent ce processus. Par exemple, un liquide se solidifie lorsque nous réduisons la température à son point de congélation, et il peut entrer dans la phase gazeuse lorsque la température est à son point d'ébullition. La transition de phase a généralement un ordre; Le solide va dans la phase liquide puis à la phase gazeuse; ou s'il s'agit d'un gaz, il doit d'abord passer par la phase liquide, puis à la phase solide. La sublimation et le dépôt sont des transitions de phase, mais elles sont un peu différentes des transitions normales car elles ne suivent pas cet ordre.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la sublimation
3. Qu'est-ce que le dépôt
4. Comparaison côte à côte - sublimation vs dépôt sous forme tabulaire
5. Résumé
Qu'est-ce que la sublimation?
La sublimation est le processus de modification d'une substance solide en une substance gazeuse sans passer par la phase liquide. En termes simples, une substance solide s'évapore directement et devient un gaz sans être un liquide en premier. Cependant, ce processus a besoin d'énergie supplémentaire. Par conséquent, c'est un processus endothermique. En calculant l'enthalpie de la sublimation, nous pouvons calculer l'énergie nécessaire pour ce processus: en ajoutant à la fois l'enthalpie de fusion et l'enthalpie de vaporisation ensemble.
La sublimation se produit à des températures et des pressions en dessous du triple point de la substance. Par exemple, le dioxyde de carbone solide sublimes à une température très basse (-78.5 ° C) et à la pression atmosphérique. Le triple point de dioxyde de carbone est 5.2 ATM et -56.4 ° C, et au-dessus de ce point, nous pouvons également obtenir du dioxyde de carbone liquide. La glace et l'iode peuvent également subir une sublimation.

Figure 1: sublimation de la glace sèche
En sublimation, les propriétés chimiques du composé restent inchangées, mais les propriétés physiques peuvent changer. La sublimation est utile à diverses fins. Par exemple, il est utilisé pour purifier les composés chimiques.
Qu'est-ce que le dépôt?
Le dépôt est le processus inverse de sublimation. Il est également connu sous le nom de désublimation. Ici, une substance dans la phase gazeuse se transforme en phase solide sans passer à l'état liquide intermédiaire.

Figure 2: Formation de gel
Contrairement au processus précédent, ce processus libère de l'énergie; Par conséquent, c'est un processus exothermique. De plus, cela se produit lors de la formation de glace ou de gel. Dans ce processus, la vapeur d'eau entre directement dans la phase solide (formant de la glace ou du gel). Lorsque cela se produit, ils éliminent l'énergie thermique à l'environnement externe.
Quelle est la différence entre la sublimation et le dépôt?
La sublimation est l'opposé du dépôt. La principale différence entre la sublimation et le dépôt est que la sublimation est le changement d'une substance solide en une substance gazeuse sans passer par la phase liquide tandis que le dépôt est le changement d'une substance d'une phase gazeuse à une phase solide sans passer l'état liquide.
De plus, une différence significative entre la sublimation et le dépôt est que la sublimation est endothermique alors que le dépôt est exothermique.
L'infographie ci-dessous fournit plus de détails sur la différence entre la sublimation et le dépôt.
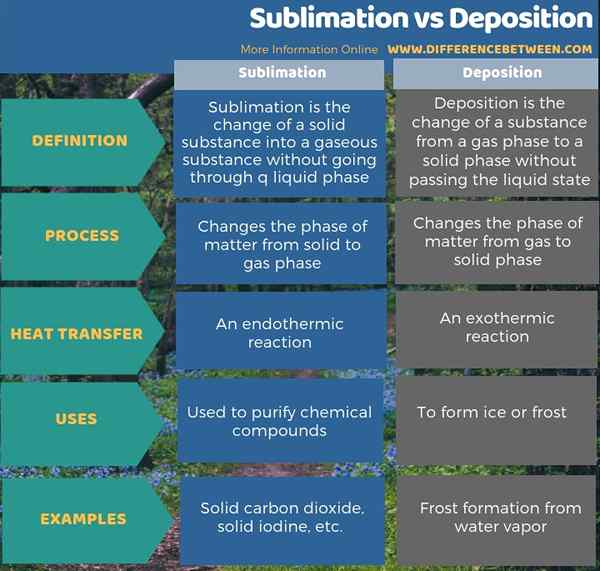
Résumé - Sublimation vs dépôt
La sublimation est l'opposé du dépôt. Cependant, ces deux processus n'impliquent pas de phase liquide. La principale différence entre la sublimation et le dépôt est que la sublimation modifie une substance solide en une substance gazeuse sans passer par la phase liquide tandis que le dépôt modifie une substance d'une phase gazeuse à une phase solide sans passer l'état liquide.
Référence:
1. «Dépôt (transition de phase).»Wikipedia, Wikimedia Foundation, 27 mars. 2019, disponible ici.
2. Helmenstine, Anne Marie, Ph.D. «Définition de sublimation (transition de phase en chimie)."Thoughtco, Jan. 13, 2019, disponible ici.
Image gracieuseté:
1. «Dryicesublimation» par Sarathtly - Photographie prise par moi (domaine public) via Commons Wikimedia
2. «Frost Patterns 4» par Schnobby - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


