Différence entre le chlorure stannique et stanneux
Le différence clé entre le chlorure stannique et stanneux est que Le chlorure stannique a l'état d'oxydation +4 de l'étain, tandis que le chlorure stanneux a l'état d'oxydation +2 de l'étain.
Les noms stanniques et stannous se réfèrent à l'étain d'élément chimique ayant deux états d'oxydation différents. Le chlorure stannique est un chlorure d'étain (iv) tandis que le chlorure stanneux est un chlorure d'étain (ii).
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le chlorure stannique
3. Qu'est-ce que le chlorure stanneux
4. Comparaison côte à côte - chlorure stannique vs stanneux sous forme tabulaire
5. Résumé
Qu'est-ce que le chlorure stannique?
Le chlorure stannique est un chlorure d'étain (iv). Il est également connu sous le nom de tétrachlorure d'étain, qui est un composé inorganique ayant la formule chimique SNCL4. Ce composé est un liquide hygroscopique incolore qui subit une fumer au contact de l'air. Il a une odeur âcre. Ce composé est important comme précurseur pour la production d'autres composés contenant de l'étain. Il a été découvert par le scientifique Andreas Libavius.

Figure 01: composé de chlorure stannique
Nous pouvons préparer du chlorure stannique via la réaction entre le chlore gazeux et le métal en étain à 115 degrés Celsius. De plus, ce composé se solidifie à environ moins 33 degrés Celsius degrés. Cette solidification donne des cristaux monocliniques, et cette structure est isostructurale avec SNBR4. Il existe plusieurs hydrates connus de chlorure stannique, comme la forme pentahydrate. La structure hydratée a des molécules d'eau supplémentaires qui relient les molécules de chlorure stanniques ensemble à travers des liaisons hydrogène.
Lorsque vous envisagez les utilisations du chlorure stannique, l'application principale de ce composé est un précurseur des composés organotiques qui sont utiles comme catalyseurs et stabilisateurs de polymère. Nous pouvons utiliser ce composé dans le processus sol-gel afin de préparer le revêtement SNO2, les nanocristaux de SNO2, etc.
Qu'est-ce que le chlorure stanneux?
Le chlorure stanneux est un chlorure d'étain (ii). Il apparaît comme un solide cristallin blanc ayant la formule chimique SNCL2. La forme principale de ce composé est la forme de dihydrate, mais les solutions aqueuses de chlorure stanneuses ont tendance à subir une hydrolyse lorsque la solution est chaude. De plus, SNCL2 est largement utilisé comme agent réducteur, et il est également important dans les bains électrolytiques pour la placage de l'étain. Ce solide blanc est inodore, ce qui est une différence avec le chlorure stannique.
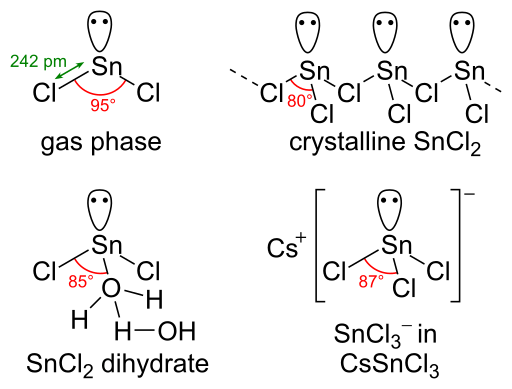
La molécule SNCL2 a une paire d'électrons solitaires; Par conséquent, cette molécule a une géométrie courbée dans sa phase gazeuse. Lorsque l'état solide du chlorure stanneux est considéré, il forme une structure de chaîne qui est liée via des ponts de chlorure.

Figure 02: Structures de chlorure stanneux en différentes phases
Nous pouvons préparer du chlorure stanneux via l'action du chlorure d'halogène sec sur du métal en étain. Nous pouvons produire la forme de dihydrate par une réaction similaire en utilisant l'acide HCl. Par la suite, l'eau présente dans la solution doit être soigneusement éliminée par évaporation pour obtenir les cristaux de chlorure stanneux dihydraté. Cette forme de dihydrate peut subir une déshydratation à une forme anhydre en utilisant de l'anhydride acétique.
Il existe de nombreuses utilisations différentes de chlorure stanneux, y compris le placage en étain d'acier, comme mordant dans la teinture textile car il donne des couleurs vives avec quelques colorants, comme agent protecteur contre l'érosion de l'émail dans le dentifrice, comme catalyseur dans la production de matières plastiques APL , en tant qu'agent réducteur, etc.
Quelle est la différence entre le chlorure stannique et stanneux?
Les noms stanniques et stannous se réfèrent à l'étain d'élément chimique ayant deux états d'oxydation différents. La principale différence entre le chlorure stannique et stanneux est que le chlorure stannique a l'état d'oxydation +4 de l'étain, tandis que le chlorure stanneux a l'état d'oxydation +2 de l'étain. Lorsque l'on considère la préparation de ces deux composés, le chlorure stannique peut être fait via la réaction entre le chlore gazeux et le métal en étain à 115 degrés Celsius. Le chlorure stanneux peut être fabriqué via l'action du chlorure d'halogène sec sur du métal en étain.
Ci-dessous énumère plus de différences entre le chlorure stannique et stanneux.
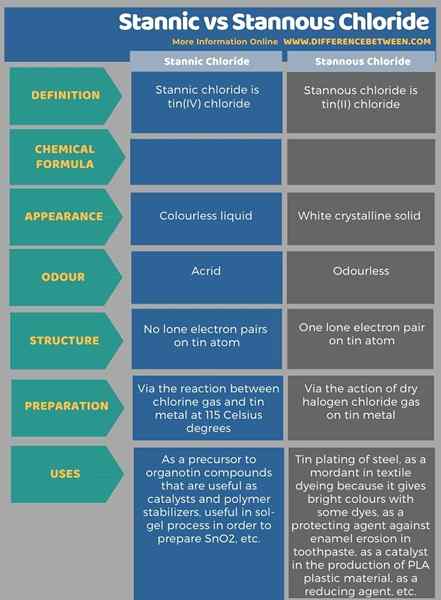
Résumé - Stannic vs chlorure stanneux
Les noms stanniques et stannous se réfèrent à l'étain d'élément chimique ayant deux états d'oxydation différents. La principale différence entre le chlorure stannique et stanneux est que le chlorure stannique a l'état d'oxydation +4 de l'étain, tandis que le chlorure stanneux a l'état d'oxydation +2 de l'étain.
Référence:
1. «Chlorure stanneux.»Chlorure stanneux - Un aperçu | ScienceDirect Sujets, disponibles ici.
Image gracieuseté:
1. «Étain (iv) chlorure pentahydrate» (domaine public) via les communes Wikimedia
2. «Strcl2 Structure» par HBF878 - Propre travaux (CC0) via Commons Wikimedia


