Différence entre l'hybridation SP3D2 et D2SP3
Différence clé - SP3D2 VS d2sp3 Hybridation
Il existe des structures hypothétiques appelées orbitales dans un atome dans lequel les électrons résident. Différentes découvertes scientifiques ont proposé différentes formes pour ces orbitales. Les orbitales atomiques peuvent subir un processus appelé hybridation. L'hybridation des orbitales se produit pour obtenir des formes appropriées nécessaires à la liaison chimique. L'hybridation est le mélange d'orbitales atomiques pour former des orbitales hybrides. sp3d2 et d2sp3 sont de telles orbitales hybrides. Le différence clé Entre SP3d2 et d2sp3l'hybridation est que sp3d2 L'hybridation implique des orbitales atomiques de la même coque d'électrons alors que D2sp3 L'hybridation implique des orbitales atomiques de deux coquilles d'électrons.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'hybridation SP3D2
3. Qu'est-ce que l'hybridation D2SP3
4. Similitudes entre l'hybridation SP3D2 et D2SP3
5. Comparaison côte à côte - Hybridation SP3D2 VS D2SP3 sous forme tabulaire
6. Résumé
Qu'est-ce que l'hybridation SP3D2
sp3d2 L'hybridation est le mélange d'orbitales atomiques S, P et D de la même coque d'électrons pour former SP3d2 orbitales hybrides. Là, une orbitale atomique S, trois orbitales atomiques P et deux orbitales atomiques D se mélangent entre elles. Ce mélange se traduit par six orbitales hybrides de même taille et de même forme mais différentes de leur orientation.
Le sp3d2 Les orbitales hybrides sont organisées en arrangement octaédrique. Ces orbitales hybrides ont 90o angles entre deux orbitales dans la disposition octaédrique. La disposition octaédrique affiche un plan carré ayant quatre orbitales hybrides et les deux orbitales restantes sont orientées au-dessus et en dessous de ce plan carré (perpendiculaire à ce plan).
Exemple
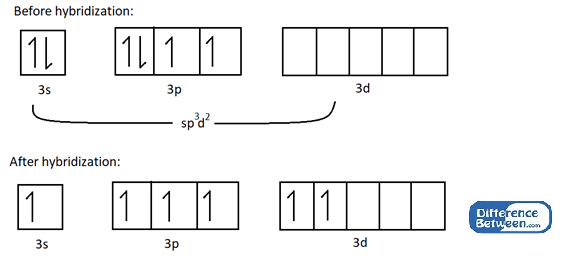
Considérons un exemple pour comprendre le SP3d2 hybridation. Ex: La molécule SF6 a une forme octaédrique car les orbitales atomiques 3S, 3P et 3D de l'atome de soufre sont mélangés pour former3d2 orbitales hybrides.

Figure 01: Structure électronique de l'atome de soufre avant et après l'hybridation.
Comme le montre l'image ci-dessus, l'hybridation se traduit par six électrons non appariés qui peuvent participer à une liaison chimique avec six atomes de fluor. Plus important encore, toutes les orbitales atomiques impliquées dans cette hybridation sont dans la même coque d'électrons (dans l'exemple ci-dessus, c'est n = 3 coque d'électrons).
Qu'est-ce que l'hybridation D2SP3?
d2sp3 L'hybridation est le mélange d'orbitales atomiques s et p du même coque d'électrons avec des orbitales d d'une autre coque d'électrons pour former d2sp3 orbitales hybrides. Cette hybridation se traduit par six orbitales hybrides. Ces orbitales hybrides sont disposées en géométrie octaédrique.
Plus important encore, dans cette hybridation, les orbitales atomiques D proviennent d'une coque d'électrons différente (coquille d'électrons n-1) tandis que les orbitales atomiques S et P sont de la même coque d'électrons. Considérons un exemple pour comprendre cette hybridation. La plupart des complexes d'ions métalliques sont composés de d2sp3 orbitales hybrides.
Exemple
Par exemple, prenez le CO (NH3)3+ complexe.
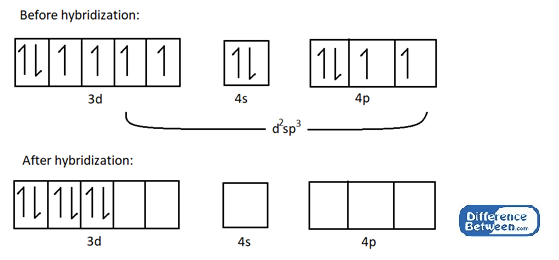
Figure 02: Structure électronique de l'atome de cobalt (CO) avant et après l'hybridation.
Comme le montre l'image ci-dessus, il y a six orbitales hybrides vides dans l'atome de cobalt après l'hybridation. Ces orbitales vides peuvent participer à la formation de liaisons chimiques de coordination avec des ligands (ici ligands ammoniacs = NH3).
Quelles sont les similitudes entre l'hybridation SP3D2 et D2SP3?
- Les hybridations SP3D2 et D2SP3 entraînent une géométrie octaédrique.
- Les géométries d'hybridation SP3D2 et D2SP3 ont 90o angle entre les orbitales hybrides.
- L'hybridation SP3D2 et D2SP3 entraîne six orbitales hybrides.
Quelle est la différence entre l'hybridation SP3D2 et D2SP3?
Hybridation SP3D2 vs D2SP3 | |
| sp3d2 L'hybridation est le mélange d'orbitales atomiques S, P et D de la même coque d'électrons pour former SP3d2 orbitales hybrides. | d2sp3 L'hybridation est le mélange d'orbitales atomiques s et p du même coque d'électrons avec des orbitales d d'une autre coque d'électrons pour former d2sp3 orbitales hybrides. |
| Nomenclature | |
| sp3d2 Hybridation Forms SP3d2orbitales hybrides. | d2sp3 hybridation d2sp3 orbitales hybrides. |
| Type d'orbitales atomiques | |
| sp3d2 L'hybridation implique des orbitales atomiques de la même coque d'électrons. | d2sp3 L'hybridation implique des orbitales atomiques de deux coquilles d'électrons. |
| D orbitales | |
| sp3d2 L'hybridation implique des orbitales atomiques d de n électrons coque. | d2sp3 L'hybridation implique des orbitales atomiques d de la coque d'électrons n-1. |
Résumé - SP3D2 VS d2sp3 Hybridation
sp3d2 hybridation et d2sp3 L'hybridation confond des termes qui sont la plupart du temps utilisés de manière interchangeable par erreur. Ce sont différents à bien des égards. La principale différence entre SP3d2 et d2sp3l'hybridation est que, sp3d2 L'hybridation implique des orbitales atomiques de la même coque d'électrons alors que D2sp3 L'hybridation implique des orbitales atomiques de deux coquilles d'électrons.
Téléchargez la version PDF de l'hybridation SP3D2 vs D2SP3
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon la note de citation. Veuillez télécharger la version PDF ici: différence entre l'hybridation SP3D2 et D2SP3
Référence:
1.«8.2: orbitales atomiques hybrides.”Chemistry LibreTexts, LibreTexts, 30 août. 2017. Disponible ici


