Différence entre les sels solubles et insolubles

Le différence clé entre les sels solubles et insolubles est que Les sels solubles peuvent se dissoudre dans l'eau à température ambiante, tandis que les sels insolubles ne peuvent pas se dissoudre dans l'eau à température ambiante.
Un sel est tout composé formé à partir de la réaction entre un acide et une base. Par conséquent, un sel contient essentiellement un anion (provient de l'acide) et un cation (vient de la base). Nous pouvons diviser les composés de sel en deux types en fonction de leur solubilité dans l'eau à température ambiante. Ce sont des sels solubles et insolubles. La solubilité des sels dépend des types d'interactions qu'ils peuvent avoir avec les molécules d'eau.
CONTENU
1. Aperçu et différence clé
2. Quels sont les sels solubles
3. Quels sont les sels insolubles
4. Comparaison côte à côte - sels solubles vs insolubles dans la forme tabulaire
5. Résumé
Quels sont les sels solubles?
Les sels solubles sont des composés de sel solubles dans l'eau à température ambiante. Ces composés de sel se dissolvent dans l'eau car ils peuvent former des attractions intermoléculaires avec des molécules d'eau. Les molécules d'eau sont polaires. Par conséquent, l'eau est un solvant polaire et les sels polaires peuvent se dissoudre dans l'eau.

Figure 01: Le chlorure de sodium est un sel soluble
Étant donné que les sels sont des composés ioniques, ils se dissolvent dans l'eau car les molécules d'eau ont tendance à attirer les ions dans le composé, ce qui les fait séparer les uns des autres, entraînant la dissolution du sel. Ici, la dissolution du sel forme des espèces ioniques dans l'eau, ce qui rend la solution aqueuse nouvellement formée hautement conductrice. Les espèces ioniques dissous dans l'eau peuvent conduire de l'électricité à travers elle. Un exemple de sel soluble est le sel de table ou le chlorure de sodium. Une solution aqueuse de sel de table contient des ions sodium et des ions de chlorure.
Quels sont les sels insolubles?
Les sels insolubles sont des composés de sel insolubles dans l'eau à température ambiante. Ceux-ci sont insolubles dans l'eau car les molécules d'eau ne peuvent pas attirer les ions dans le composé de sel. Par conséquent, il n'y a pas d'interactions intermoléculaires entre les molécules d'eau et les composés de sel insolubles.

Figure 02: Précipité du chlorure d'argent dans l'eau
De plus, les sels insolubles sont des composés non polaires. Contrairement aux sels solubles, le mélange de sels insolubles avec de l'eau ne rend pas la solution conductrice car le sel ne se sépare pas en ions. Un bon exemple de sel insoluble est le chlorure d'argent (AGCL).
Quelle est la différence entre les sels solubles et insolubles?
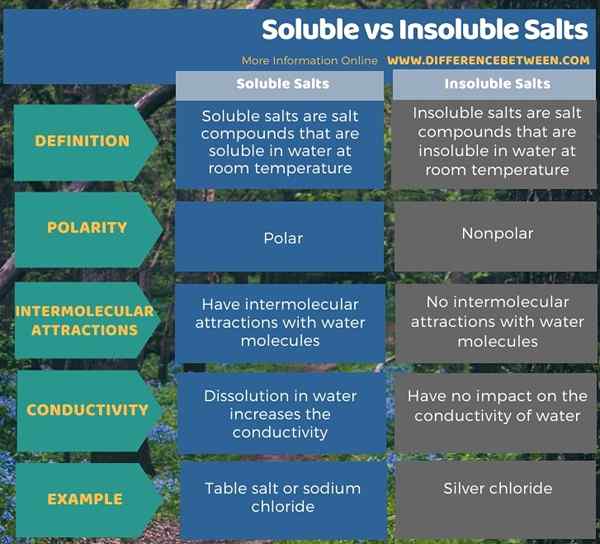
Nous pouvons diviser les composés de sel en deux types en fonction de leur solubilité dans l'eau. Ce sont des sels solubles et insolubles. La principale différence entre les sels solubles et insolubles est que les sels solubles peuvent se dissoudre dans l'eau à température ambiante, tandis que les sels insolubles ne peuvent pas se dissoudre dans l'eau à température ambiante. De plus, les sels solubles sont polaires; C'est pourquoi ils peuvent se dissoudre dans l'eau, qui est un solvant polaire. En revanche, les sels insolubles sont non polaires. C'est donc une autre différence significative entre les sels solubles et insolubles.
En plus de ce qui précède, les molécules d'eau peuvent former des attractions intermoléculaires avec les ions des sels solubles, mais il n'y a pas d'interactions intermoléculaires entre les sels insolubles et l'eau. De plus, la dissolution des sels solubles dans l'eau constitue une solution aqueuse hautement conductrice car les ions dissous dans l'eau peuvent conduire de l'électricité à travers elle. Contrairement aux sels solubles, mélanger les sels insolubles avec de l'eau ne rend pas l'eau conductrice. Le chlorure de sodium est un exemple de sels solubles, tandis que le chlorure d'argent est un exemple de sel insoluble.
Résumé - Salts solubles vs insolubles
Nous pouvons diviser les composés de sel en deux types en fonction de leur solubilité dans l'eau. Ce sont des sels solubles et insolubles. La principale différence entre les sels solubles et insolubles est que les sels solubles peuvent se dissoudre dans l'eau à température ambiante, tandis que les sels insolubles ne peuvent pas se dissoudre dans l'eau à température ambiante. De plus, les sels solubles sont polaires; C'est pourquoi ils peuvent se dissoudre dans l'eau, qui est un solvant polaire. En revanche, les sels insolubles sont non polaires.
Référence:
1. «Sels insolubles.”Chemistry LibreTexts, LibreTexts, 5 juin 2019, disponible ici.
2. «Définition des sels insolubles (précipiter).”CEHMICOOL DICTIONNAIRE, disponible ici.
3. «Sels insolubles.”Salts-tripod, disponible ici.
Image gracieuseté:
1. «Chlorure de sodium» par chimie - son propre travail (domaine public) via les communes Wikimedia
2. «Silver Chlorure (AGCL)» par Luisbrudna - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


