Différence entre le blindage et l'effet de dépistage
Différence clé - Blindage vs Dépistage Effet
L'effet de blindage est la réduction de la charge nucléaire efficace sur le nuage d'électrons, en raison d'une différence dans les forces d'attraction des électrons dans le noyau. En d'autres termes, c'est la réduction de l'attraction entre le noyau atomique et les électrons les plus externes en raison de la présence d'électrons de coque intérieure. L'effet de blindage et l'effet de dépistage des termes signifient le même. Il n'y a pas de différence entre l'effet de blindage et l'effet de dépistage.
CONTENU
1. Aperçu et différence clé
2. Quel est l'effet de blindage
3. Qu'est-ce que l'effet de dépistage
4. Bounding vs Effet de dépistage
5. Résumé
Quel est l'effet de blindage?
L'effet de blindage est la réduction de la charge nucléaire efficace sur le nuage d'électrons, en raison des différences dans les forces d'attraction entre les électrons et le noyau. Ce terme décrit les forces d'attraction entre les électrons et le noyau d'un atome ayant plus d'un électron. Il est également appelé blindage atomique.
L'effet de blindage donne la réduction de l'attraction entre le noyau atomique et les électrons les plus externes dans un atome contenant de nombreux électrons. La charge nucléaire efficace est la charge positive nette subie par les électrons dans les coquilles d'électrons les plus externes d'un atome (électrons de valence). Lorsqu'il existe de nombreux électrons de coque intérieure présents, le noyau atomique a moins d'attraction du noyau atomique. C'est parce que le noyau atomique est protégé par les électrons. Le nombre d'électrons intérieurs est élevé, l'effet de blindage est élevé. L'ordre d'augmenter l'effet de blindage est le suivant.
S orbital> p orbital> d orbital> f orbital
Il y a des tendances périodiques de l'effet de blindage. Un atome d'hydrogène est le plus petit atome dans lequel un électron est présent. Il n'y a pas d'électrons de blindage, donc la charge nucléaire efficace sur cet électron n'est pas réduite. Par conséquent, il n'y a pas d'effet de blindage. Mais lorsqu'il se déplaçant sur une période (de gauche à droite) dans le tableau périodique, le nombre d'électrons présents dans l'atome augmente. Ensuite, l'effet de blindage est également augmenté.
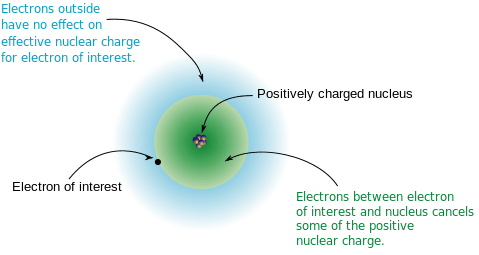
L'énergie d'ionisation des atomes est déterminée principalement par l'effet de blindage. L'énergie d'ionisation est la quantité d'énergie nécessaire pour éliminer l'électron le plus externe d'un atome ou d'un ion. Si l'effet de blindage est élevé, alors l'électron le plus externe de cet atome est moins attiré par le noyau atomique, en d'autres termes, les électrons les plus externes sont facilement retirés. Par conséquent, l'effet de blindage est élevé, moins l'énergie d'ionisation.

Figure 01: l'effet de blindage sur un électron
Cependant, il existe quelques exceptions de valeurs d'énergie d'ionisation lorsqu'ils se déplacent sur une période du tableau périodique. Par exemple, l'énergie d'ionisation de Mg (magnésium) est plus élevée que celle d'Al (aluminium). Mais le nombre d'électrons dans Al est supérieur à celui de Mg. Cela se produit parce que l'atome d'Al a l'électron le plus externe dans une orbitale 3p et cet électron n'est pas apparié. Cet électron est protégé par deux électrons 3s. Dans Mg, les électrons les plus externes sont deux électrons 3s qui sont appariés dans la même orbite. Par conséquent, la charge nucléaire efficace sur l'électron de valence d'Al est inférieure à celle de Mg. Par conséquent, il est facile d'être retiré de l'atome d'Al, ce qui entraîne une énergie d'ionisation moins que par rapport à Mg.
Qu'est-ce que l'effet de dépistage?
L'effet de dépistage est également connu sous le nom d'effet de blindage. C'est l'effet de la réduction de l'attraction entre le noyau atomique et les électrons les plus externes en raison de la présence d'électrons de coque intérieure. Cela se produit parce que les électrons de la coque intérieure protègent le noyau atomique.
Quelle est la différence entre l'effet de blindage et de dépistage
- L'effet de blindage est la réduction de la charge nucléaire efficace sur le nuage d'électrons, en raison des différences dans les forces d'attraction entre les électrons et le noyau. L'effet de blindage est également connu comme l'effet de dépistage. Par conséquent, il n'y a pas de différence entre ces deux termes. Ils signifient principalement la même chose.
Résumé
L'effet de blindage ou l'effet de dépistage est la réduction de l'attraction entre le noyau atomique et les électrons les plus externes en raison de la présence d'électrons de coque intérieure. L'effet de blindage provoque la réduction de la charge nucléaire efficace sur un électron. Les électrons de valence sont affectés par cet effet. Il n'y a pas de différence entre l'effet de blindage des termes et l'effet de carélation.
Référence:
1.«6.17: Boundage électronique.”Chemistry LibreTexts, LibreTexts, 23 août. 2017. Disponible ici
2.«Effet de blindage.”Effet de blindage | Définition | Tendance | Tutorvista. Disponible ici
3.«Effet de blindage.»Wikipedia, Wikimedia Foundation, 5 mars. 2018. Disponible ici
Image gracieuseté:
1.«Diagramme de charge nucléaire efficace» Frozenman (domaine public) via Commons Wikimedia


