Différence entre forme et géométrie d'une molécule
Le différence clé entre la forme et la géométrie d'une molécule est que La forme d'une molécule est la structure de la molécule, à l'exclusion de la paire seule sur l'atome central, tandis que la géométrie d'une molécule décrit la disposition des électrons de paire solitaire et de liaison autour de l'atome central de la molécule.
Nous utilisons généralement les termes - forme et géométrie d'une molécule - interchangeable. Cependant, ce sont deux termes différents pour certaines molécules que nous connaissons.
CONTENU
1. Aperçu et différence clé
2. Quelle est la forme d'une molécule
3. Qu'est-ce que la géométrie d'une molécule
4. Comparaison côte à côte - forme vs géométrie d'une molécule sous forme tabulaire
5. Résumé
Quelle est la forme d'une molécule?
La forme d'une molécule est la structure de la molécule prédite à l'aide de la paire d'électrons de liaison sur l'atome central. En d'autres termes, la forme d'une molécule est déterminée à l'exclusion des paires d'électrons solitaires de l'atome central. La forme de la molécule peut être prédite en utilisant le modèle VSEPR (modèle de répulsion de la paire d'électrons de la coque de valence).
Le modèle VSEPR est la théorie qui détermine la forme et la géométrie d'une molécule. Nous pouvons utiliser ce modèle VSEPR pour proposer un arrangement spatial pour les molécules ayant des liaisons covalentes ou des liaisons de coordination. La base de cette théorie est les répulsions entre les paires d'électrons dans la coquille de valence des atomes. Ici, nous pouvons trouver des paires d'électrons en deux types sous forme de paires de liaisons et de paires solitaires. Il existe trois types de répulsion présents entre ces paires d'électrons; Paire de liaisons - Répulsion de la paire isolée, répulsion de la paire de paires de liaisons et répulsion de paire de paires solitaires. Par exemple, la forme de la molécule de chlorure de béryllium est prédite comme suit:
L'atome central est.
Il a 2 électrons de valence.
CL ATOM peut partager un électron par atome.
Par conséquent, le nombre total d'électrons autour de l'atome central = 2 (à partir de BE) + 1 × 2 (des atomes CL) = 4
Par conséquent, le nombre de paires d'électrons autour de l'atome be = 4/2 = 2
Nombre d'obligations uniques présentes = 2
Nombre de paires isolées présentes = 2 - 2 = 0
Par conséquent, la géométrie de la molécule Becl2 est linéaire.
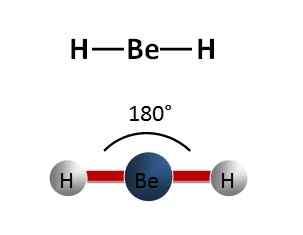
Figure 01: molécule BEH2, qui est similaire à la forme de la molécule de chlorure de béryllium
Qu'est-ce que la géométrie d'une molécule?
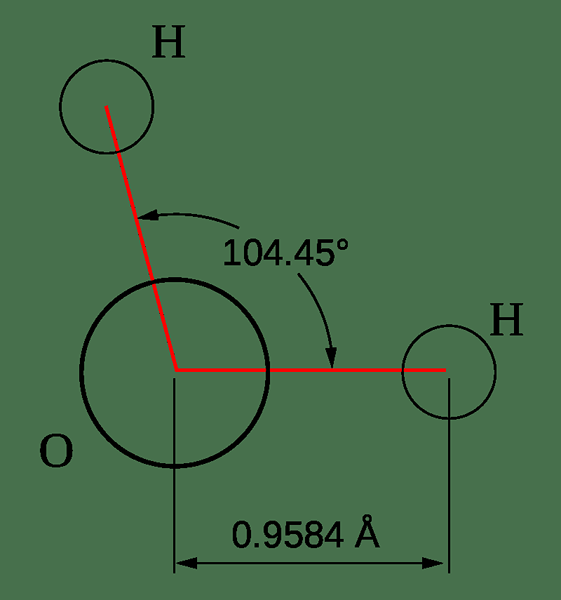
La géométrie d'une molécule est la structure de la molécule, y compris les paires d'électrons solitaires et les paires d'électrons de liaison de l'atome central. Par conséquent, ce terme est différent de la forme d'une molécule car la forme d'une molécule est déterminée en utilisant uniquement la paire d'électrons de liaison, à l'exclusion des paires d'électrons solitaires.

Figure 02: Géométrie d'une molécule d'eau
Il existe différentes méthodes pour déterminer la géométrie d'une molécule, telles que diverses méthodes spectroscopiques, méthodes de diffraction, etc.
Quelle est la différence entre la forme et la géométrie d'une molécule?
La principale différence entre la forme et la géométrie d'une molécule est que la forme d'une molécule est la structure de la molécule excluant la paire isolée sur l'atome central tandis que la géométrie d'une molécule décrit la disposition de la paire solitaire et des électrons de paire de liaisons autour de l'atome central de la molécule. Habituellement, la forme des termes et la géométrie d'une molécule sont utilisées de manière interchangeable parce que ces deux structures sont généralement les mêmes pour la plupart des molécules s'il n'y a pas de paires d'électrons solitaires sur l'atome central de la molécule.
L'infographie ci-dessous résume les différences entre la forme et la géométrie d'une molécule.
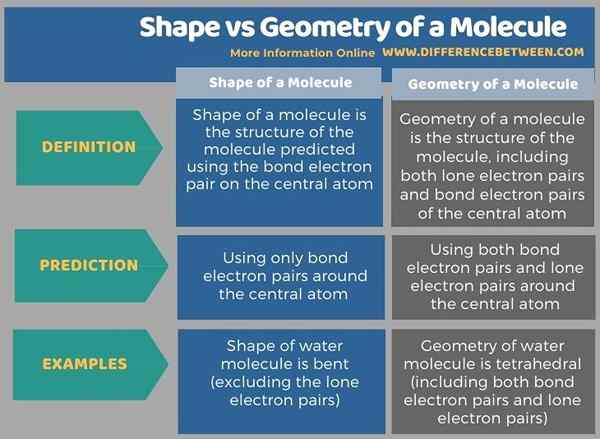
Résumé - forme vs géométrie d'une molécule
La forme d'une molécule est la structure de la molécule prédite à l'aide de la paire d'électrons de liaison sur l'atome central tandis que la géométrie d'une molécule est la structure de la molécule, y compris les paires d'électrons solitaires et les paires d'électrons de liaison de l'atome central. Ainsi, c'est la principale différence entre la forme et la géométrie d'une molécule. Habituellement, les termes, la forme et la géométrie d'une molécule sont utilisées de manière interchangeable parce que ces deux structures sont généralement les mêmes pour la plupart des molécules s'il n'y a pas de paires d'électrons solitaires sur l'atome central de la molécule.
Référence:
1. «Géométrie des molécules.”LiBerTexts, disponible ici.
Image gracieuseté:
1. «Linear Molecule Ex» par Meeshko - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Dimensions de la molécule d'eau» par Booyabazooka - Image: Water_Molecule_dimensions.png (cc by-sa 3.0) via Commons Wikimedia


