Différence entre le soufre rhombique et monoclinique

Le différence clé entre le soufre rhombique et monoclinique est que le Le soufre rhombique est la forme allotrope la plus stable de soufre qui existe en tant que cristaux octaédriques rhombiques tandis que le soufre monoclinique existe comme des prismes en forme d'aiguille Mais, il n'est stable qu'à des températures entre 96◦C et 119◦C.
Le soufre, également orthographié comme «soufre», est un élément chimique ayant les symboles chimiques et le numéro atomique 16. C'est un non-métal et se produit dans la nature sous différentes formes allotropes. De plus, à température ambiante, il est facilement disponible sous forme de cristaux de couleur jaune vif. Les principales sources de soufre comprennent le gaz naturel, l'extraction sous la croûte terrestre et comme sous-produits d'autres processus chimiques. Le soufre rhombique et monoclinique est deux formes allotropes; Les allotropes sont les différentes formes du même élément chimique qui existe dans le même état physique, je.e. modifications structurelles. Non seulement la structure mais aussi la méthode de préparation de ces allotropes sont également différentes les unes des autres.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le soufre rhombique
3. Qu'est-ce que le soufre monoclinique
4. Comparaison côte à côte - Forme tabulaire rhombique vs monoclinique sulfurine
5. Résumé
Qu'est-ce que le soufre rhombique?
Le soufre rhombique, ou alpha-sulfure, est une forme allotrope cristalline de soufre qui a des cristaux octaédriques rhombiques. C'est la forme la plus stable d'allotrope parmi d'autres allotropes de soufre. Par conséquent, presque tous les autres allotropes finissent par se convertir en forme rhombique.

Figure 01: cristaux de soufre de Rhombi
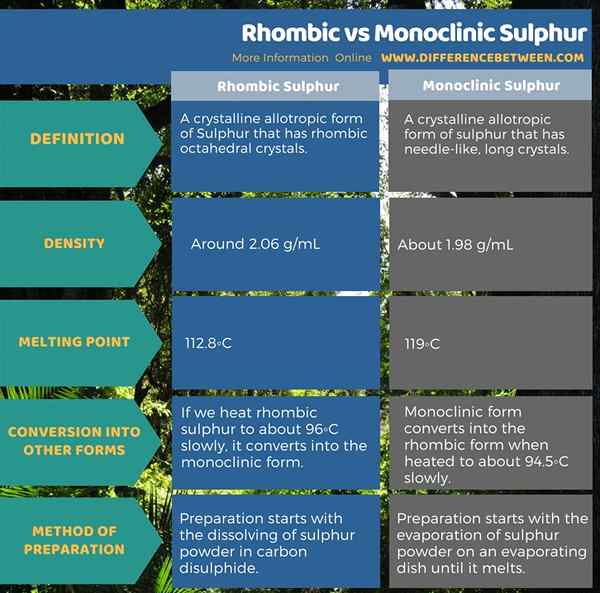
Lorsque vous envisagez la méthode de préparation, nous devons d'abord dissoudre la poudre de soufre dans le disulfure de carbone (à température ambiante); c'est insoluble dans l'eau. Ensuite, nous pouvons filtrer le mélange à l'aide d'un papier filtre. Après la filtration, nous devons garder le filtrat dans un bécher, recouvert d'un papier filtre. Cela permet au disulfure de carbone de s'évaporer lentement, laissant les cristaux alpha-soufre. La densité de ces cristaux est d'environ 2.06 g / ml, et le point de fusion est à 112.8 ° C. Si nous chauffons lentement le soufre rhombique à environ 96 ° C, il se transforme en forme monoclinique.
Qu'est-ce que le soufre monoclinique?
Le soufre monoclinique est une forme allotrope cristalline de soufre qui a des cristaux longs en forme d'aiguille. Ces cristaux apparaissent comme des prismes; Par conséquent, nous pouvons appeler ces cristaux comme un soufre prismatique. Il n'est pas autant stable que le soufre rhombique, il se transforme donc en forme rhombique lorsqu'il est chauffé à environ 94.5◦C lentement. La forme monoclinique est stable au-dessus de 96◦C.
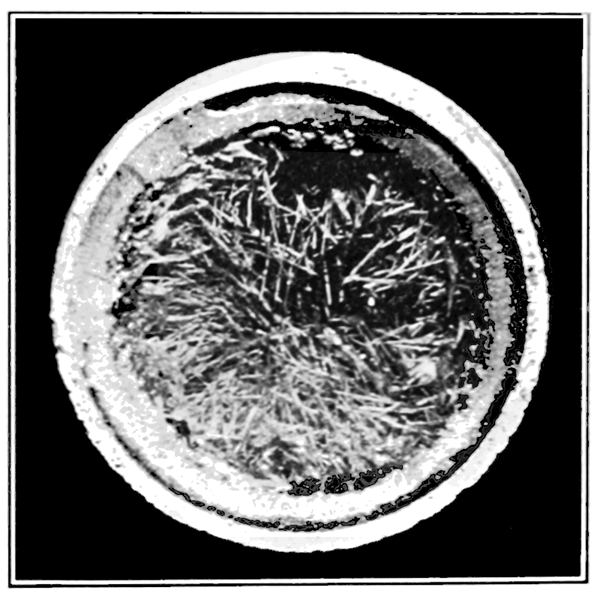
Figure 02: cristaux de soufre monoclinique
La densité de cette forme allotrope est d'environ 1.98 g / ml, et le point de fusion est de 119◦C. À des températures inférieures à 96 ° C, elle se transforme sous forme rhombique. Lorsque vous envisagez la méthode de préparation de cette forme, nous devons d'abord chauffer la poudre de soufre sur un plat d'évaporation, jusqu'à ce que la poudre de soufre fonde. Ensuite, nous devons le laisser refroidir jusqu'à ce qu'une croûte solide se forme sur la surface. Après la formation de cette croûte, nous devons faire deux trous sur la croûte et en verser le soufre fondu. Sur le côté inférieur de la croûte, nous pouvons voir des cristaux de soufre monoclinique.
Quelle est la différence entre le soufre rhombique et monoclinique?
Le soufre rhombique est une forme allotrope cristalline de soufre qui a des cristaux octaédriques rhombiques. C'est la forme la plus stable d'allotrope parmi d'autres formes allotropes de soufre. Par conséquent, d'autres allotropes ont également tendance à se convertir en forme rhombique. Le soufre monoclinique est une forme allotrope cristalline de soufre qui a des cristaux longs en forme d'aiguille. Il est stable à des températures entre 96◦C et 119 ° C. C'est la principale différence entre le soufre rhombique et monoclinique. Plus à la différence structurelle entre le soufre rhombique et monoclinique, ils diffèrent également légèrement en certaines propriétés ainsi que dans la méthode de préparation.
Résumé - Soufre rhombique vs monoclinique
Le soufre est une substance inorganique qui a de nombreuses formes allotropes qui existent dans le même état physique. La forme rhombique et la forme monoclinique sont de tels allotropes. La différence entre le soufre rhombique et monoclinique est que le soufre rhombique existe sous forme de cristaux octaédriques rhombiques tandis que le soufre monoclinique existe comme des prismes en forme d'aiguille.
Référence:
1. «Soufre rhombique.”Modes de nutrition. Disponible ici
2. «Soufre monoclinique.”Modes de nutrition. Disponible ici
Image gracieuseté:
1.'PSM V83 D031 Crystals of Rhombic Sulphur'By inconnue - Science populaire Volume mensuel 83, (domaine public) via Commons Wikimedia
2.'PSM V83 D031 Crystals d'aiguille comme ou monoclinique Sulphur'By inconnue (domaine public) via Commons Wikimedia


