Différence entre la loi de Raoult et la loi Dalton
Le différence clé entre la loi de Raoult et la loi de Dalton La loi de Raoult traite de la pression de vapeur des solides ou des liquides, tandis que la loi de Dalton traite de la pression partielle des gaz non réagus.
La loi de Raoult et la loi de Dalton sont des lois très importantes en chimie qui expliquent les pressions partielles des États gazeux. La loi de Raoult décrit le comportement de la pression partielle de la vapeur d'une solution lors de la modification de la concentration de soluté. En revanche, Dalton Law décrit le comportement des gaz non réagus dans le même navire.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la loi Raoult
3. Qu'est-ce que la loi Dalton
4. Comparaison côte à côte - Raoult Law vs Dalton Law sous forme tabulaire
6. Résumé
Qu'est-ce que la loi Raoult?
La loi de Raoult indique que la pression de vapeur d'un solvant au-dessus d'une solution est égale à la pression de vapeur du solvant pur à la même température mise à l'échelle par la fraction molaire du solvant présent dans la solution. Nous pouvons donner cette relation mathématiquement comme suit:
Psolution= Xsolvant.Posolvant
Où psoldat est la pression de vapeur de la solution, xsolvant est la fraction molaire du solvant et posolvant est la pression de vapeur du solvant pur. La loi a été développée par le chimiste français, François-Marie Raoult en 1880. Il a découvert que lors de l'ajout d'un soluté à une solution, la pression de vapeur de la solution diminue progressivement. Cependant, cette observation dépendait de deux variables: la fraction molaire du soluté dissous et la pression de vapeur du solvant pur.
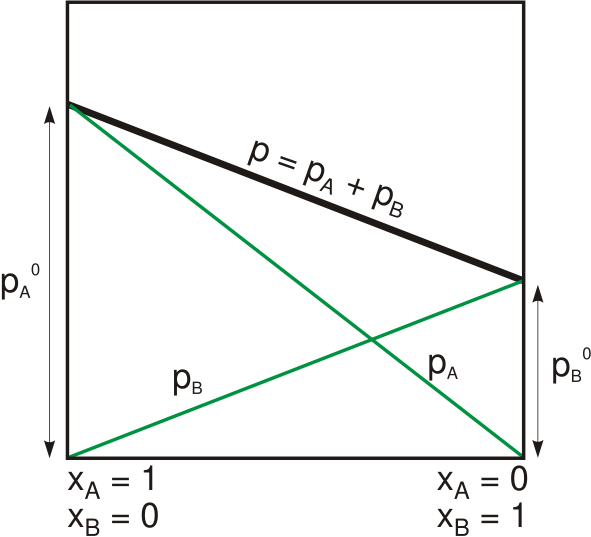
Figure 01: Pression de vapeur d'une solution binaire qui suit la loi de Raoult
À une pression donnée pour un solide ou un liquide particulier, il y a une pression à laquelle la vapeur de la substance est en équilibre avec la substance sous forme solide ou liquide. À cette température, nous nommons la pression au-dessus de la substance comme pression de vapeur. De plus, à cet équilibre, le taux d'évaporation de la substance solide ou liquide est égal à la vapeur qui se condense à la forme solide ou liquide. Ainsi, c'est la théorie de base derrière la loi Raoult. Cependant, Raoult Law travaille pour des solutions idéales. Mais cela fonctionne également bien avec les solvants dans un état très dilué. Pour les substances réelles (non substances idéales), la diminution de la pression de vapeur est pratiquement supérieure à la valeur que nous calculons à partir de la loi Raoult.
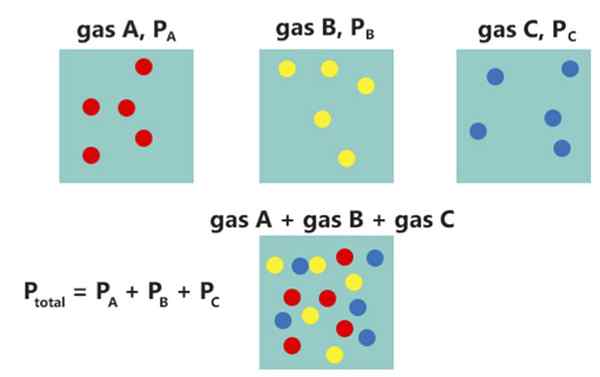
Qu'est-ce que la loi Dalton?
La loi de Dalton stipule que la pression totale d'un mélange de gaz non réagis est égal à la somme des pressions partielles de chaque gaz. La loi a été développée par John Dalton en 1802. Nous pouvons donner cette loi mathématiquement comme suit:
Ptotal= Pje
Où ptotal est la pression totale du mélange de gaz tandis que pje est la pression partielle de chaque gaz individuel.

Figure 02: Law Dalton
Par exemple, si nous avons un mélange de gaz non réagissant avec trois composants, nous pouvons écrire la relation comme suit:
Ptotal = P1+P2+P3
Quelle est la différence entre Raoult Law et Dalton Law?
La loi de Raoult et la loi de Dalton sont des lois très importantes en chimie qui expliquent les pressions partielles des États gazeux. La principale différence entre la loi de Raoult et la loi de Dalton est que la loi de Raoult traite de la pression de vapeur des solides ou des liquides, tandis que la loi de Dalton traite de la pression partielle des gaz non réagis. C'est-à-dire; La loi de Raoult indique que la pression de vapeur d'un solvant au-dessus d'une solution est égale à la pression de vapeur du solvant pur à la même température mise à l'échelle par la fraction molaire du solvant présent dans la solution. Pendant ce temps, la loi de Dalton stipule que la pression totale d'un mélange de gaz non réagisse équivaut à la somme des pressions partielles de chaque gaz. L'expression mathématique de Raoult Law est Psolution= Xsolvant.Posolvant tandis que l'expression mathématique de la loi Dalton est ptotal= Pje.

Résumé - Raoult Law vs Dalton Law
La loi de Raoult et la loi de Dalton sont des lois très importantes en chimie qui expliquent les pressions partielles des États gazeux. Cependant, la principale différence entre la loi de Raoult et le droit de Dalton est que la loi de Raoult traite de la pression de vapeur des solides ou des liquides, tandis que la loi de Dalton traite de la pression partielle des gaz non réagis.
Référence:
1. Helmenstine, Anne Marie. «Définition de la loi de Raoult en chimie."Thoughtco, Jan. 9, 2019, disponible ici.
Image gracieuseté:
1. «Raoultov Zakon» (domaine public) via Commons Wikimedia
2. «Schéma représentant la loi de Dalton» par Blyumj - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


