Différence entre les orbitales pures et hybrides
Le différence clé entre les orbitales pures et hybrides est que le Les orbitales pures sont les orbitales atomiques d'origine tandis que les orbitales hybrides se forment à partir du mélange de deux orbitales atomiques ou plus.
Dans la formation de liaison chimique de molécules simples, nous pouvons simplement considérer le chevauchement des orbitales atomiques. Mais si nous voulons discuter de la liaison chimique dans des molécules complexes, nous devons savoir ce qu'est l'hybridation orbitale. L'hybridation orbitale est le concept chimique qui décrit le mélange des orbitales atomiques pour former de nouvelles orbitales hybrides. Ces orbitales impliquent la formation de liaisons chimiques covalentes.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les orbitales pures
3. Que sont les orbitales hybrides
4. Comparaison côte à côte - orbitales hybrides pures vs sous forme tabulaire
5. Résumé
Quelles sont les orbitales pures?
Les orbitales pures sont des orbitales atomiques qui contiennent des électrons de l'atome. Ces orbitales ne sont pas des orbitales mixtes comme des orbitales hybrides. L'orbitale donne l'emplacement le plus probable des électrons dans un atome car les électrons sont en mouvement continu autour du noyau atomique. Plutôt qu'un emplacement fixe, cela donne une région où l'électron peut se produire à un moment particulier.
Les orbitales atomiques pures existent dans plusieurs formes telles que la forme sphérique, la forme d'haltères. Selon la mécanique quantique, il existe un ensemble de nombres quantiques que nous utilisons pour nommer une orbitale. Cet ensemble de nombres comprend N (principal numéro quantique), L (nombre quantique de moment angulaire), M (nombre quantique magnétique) et S (numéro quantique de spin). Chaque orbitale occupe un maximum de deux électrons. Selon le nombre quantum de moment angulaire, il existe quatre orbitales atomiques communément connues sous le nom d'orbital s (de forme sphérique), de p orbital (en forme d'haltère), d'orbital D (deux haltères dans le même plan) et de l'orbital f (une structure compliquée).
Que sont les orbitales hybrides?
Les orbitales hybrides sont les orbitales moléculaires qui se forment à partir du mélange des orbitales atomiques. Ce sont des orbitales hypothétiques. Le mélange se produit entre les orbitales atomiques du même atome. Ce mélange se produit pour former une liaison chimique covalente avec un autre atome. Le processus de ce mélange est «l'hybridation orbitale» qui entraîne des orbitales hybrides. Nous nommons ces orbitales selon les orbitales atomiques qui subissent une hybridation.

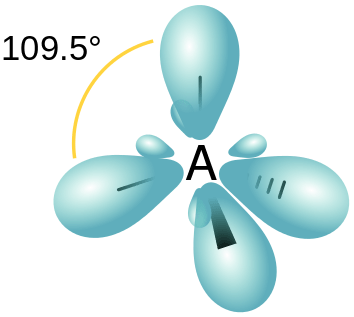
Figure 01: Hybridation SP3
En conséquence, les trois principales formes d'orbitales hybrides sont:
- SP Hybrid Orbital - Cela se forme en raison de l'hybridation des orbitales atomiques S et P. Par conséquent, l'orbitale hybride résultant a 50% de caractéristiques S et 50% de caractéristiques orbitales P. Cette orbitale hybride a un arrangement spatial linéaire.
- sp2 Orbital hybride - Cela se forme en raison de l'hybridation d'un S et de deux orbitales P. Par conséquent, l'orbitale hybride résultante a 33% des caractéristiques orbitales S et 66% de la caractéristique orbitale p. La disposition spatiale est planaire trigonal.
- sp3 Orbital hybride - Cela se forme en raison de l'hybridation d'un S et de trois orbitales P. Par conséquent, l'orbitale hybride résultant a 25% de caractéristiques S et 75% de caractéristiques P. La disposition spatiale de ces orbitales hybrides est tétraédrique.
Quelle est la différence entre les orbitales pures et hybrides?
Les orbitales pures sont des orbitales atomiques qui contiennent des électrons de l'atome tandis que les orbitales hybrides sont les orbitales moléculaires qui se forment à partir du mélange des orbitales atomiques. C'est la principale différence entre les orbitales pures et hybrides. De plus, les orbitales hybrides se forment via une hybridation orbitale, mais les orbitales pures ne sont pas hybrides. De plus, la formation d'orbitales hybrides est importante dans la formation de composés chimiques complexes via la formation de liaisons chimiques covalentes. Lorsque nous considérons la nomenclature des orbitales, nous nommons les orbitales pures comme s, p, d et f orbitales pendant que nous nommons des orbitales hybrides comme SP, SP2, sp3, etc.
L'infographie ci-dessous tabule la différence entre les orbitales pures et hybrides pour référence rapide.
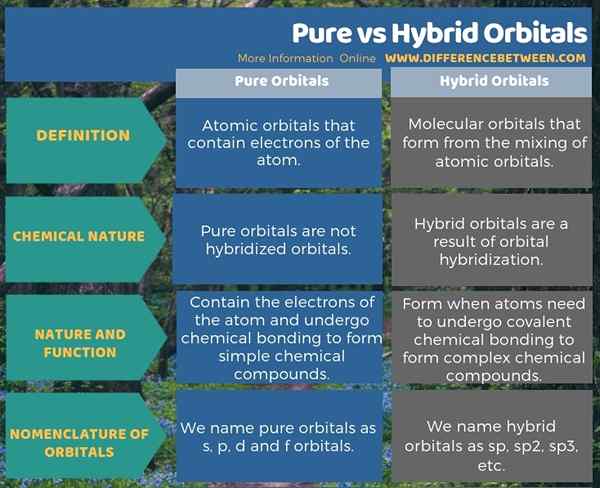
Résumé - Orbitals purs vs hybrides
Les orbitales atomiques sont les régions où les électrons existent dans les atomes. Dans cet article, nous avons décrit deux types d'orbitales comme des orbitales pures et hybrides. La principale différence entre les orbitales pures et hybrides est que les orbitales pures sont les orbitales atomiques d'origine tandis que les orbitales hybrides se forment à partir du mélange de deux orbitales atomiques ou plus.
Référence:
1. LibreTexts. «Orbitales hybrides.”Chemistry LibreTexts, LibreTexts, 21 juillet 2016. Disponible ici
Image gracieuseté:
1.«AE4H» par JFMelero - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia


