Différence entre les solvants protique et aprotique

Différence clé - Protique contre Aprotique Solvants
Le différence clé entre les solvants protique et aprotique est que Les solvants protiques ont des atomes d'hydrogène dissociables tandis que les solvants aprotiques n'ont pas d'atome d'hydrogène dissociable.
Un solvant est un composé liquide qui peut dissoudre d'autres substances. Il existe différentes formes de solvants qui peuvent être classées essentiellement en deux groupes comme solvants polaires et non polaires. Les solvants polaires peuvent être divisés en deux groupes en tant que solvants protiques et aprotiques. Les solvants protiques peuvent former une liaison hydrogène car ils ont des liaisons chimiques nécessaires à la liaison hydrogène, i.e. Obligation O-H et obligation N-H. En revanche, les solvants aprotiques n'ont pas les liaisons chimiques nécessaires à la liaison hydrogène.
CONTENU
1. Aperçu et différence clé
2. Quels sont les solvants protiques
3. Quels sont les solvants aprotiques
4. Similitudes entre les solvants protiques et aprotiques
5. Comparaison côte à côte - solvants protique vs aprotiques sous forme tabulaire
6. Résumé
Quels sont les solvants protiques?
Les solvants protiques sont des composés liquides polaires qui ont des atomes d'hydrogène dissociables. Ces solvants ont de nombreuses obligations O-H et des obligations N-H. Les atomes d'hydrogène dissociables sont ceux qui sont liés aux atomes d'oxygène et aux atomes d'azote dans ces liaisons O-H et N-H. Par conséquent, les groupes hydroxyles (-OH) et les groupes amine (-NH2) sont des composants essentiels dans les solvants protiques.
Les solvants protiques partagent la puissance de dissolution des ions avec des solvants aprotiques et sont acides (car ils peuvent libérer des protons). La constante diélectrique de ces solvants protiques est très élevée (la constante diélectrique est une propriété de matériaux d'isolation électrique et est une quantité mesurant la capacité d'une substance à stocker l'énergie électrique dans un champ électrique).
Des exemples de solvants protiques comprennent l'eau, les alcools tels que le méthanol et l'éthanol, le fluorure d'hydrogène (HF) et l'ammoniac (NH3). Ces solvants sont souvent utilisés pour dissoudre les sels. Les solvants protiques polaires préfèrent subir des réactions SN1.
Quels sont les solvants aprotiques?
Les solvants aprotiques sont des composés liquides polaires qui n'ont pas d'atomes d'hydrogène dissociables. Ces solvants manquent de corps chimiques tels que les liaisons O-H et les liaisons N-H. Par conséquent, les solvants aprotiques manquent de groupes hydroxyle (-OH) et de groupes amine (-NH2) et sont incapables de former des liaisons hydrogène.
Les solvants aprotiques partagent le pouvoir de dissolution des ions avec des solvants protiques. Ces solvants aprotiques manquent d'hydrogène acide, donc pas de libération considérable d'ions hydrogène. Les solvants aprotiques polaires ont des valeurs constantes diélectriques faibles ou intermédiaires. Ces solvants montrent une polarité modérée.
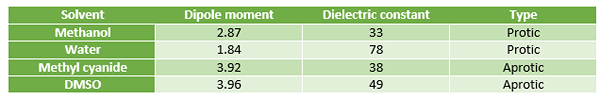
Figure 01: Comparaison entre les solvants protique et aprotique
Des exemples de solvants aprotiques comprennent le dichlorométhane (DCM), le tétrahydrofurane (THF), l'acétate d'éthyle et l'acétone. Les solvants aprotiques peuvent être utilisés pour dissoudre les sels. Ces solvants préfèrent subir des réactions SN2.
Quelles sont les similitudes entre les solvants protiques et aprotiques?
- Les solvants protiques et aprotiques sont des solvants polaires.
- Les solvants protiques et aprotiques peuvent dissoudre les sels.
Quelle est la différence entre les solvants protiques et aprotiques?
Solvants protique vs aprotic | |
| Les solvants protiques sont des composés liquides polaires qui ont des atomes d'hydrogène dissociables. | Les solvants aprotiques sont des composés liquides polaires qui n'ont pas d'atomes d'hydrogène dissociables. |
| Formation de liaisons hydrogène | |
| Les solvants protiques sont capables de formation de liaisons hydrogène. | Les solvants aprotiques sont incapables de former des liaisons hydrogène. |
| Acidité | |
| Les solvants protiques sont acides. | Les solvants aprotiques ne sont pas acides. |
| Liaisons chimiques présentes | |
| Les solvants protiques sont riches avec des liaisons O-H et des liaisons N-H. | Les solvants aprotiques manquent de liaisons O-H et de liaisons N-H. |
| Constante diélectrique | |
| Les solvants protiques ont une constante diélectrique élevée. | Les solvants aprotiques ont une faible constante diélectrique. |
| Type de réaction préféré | |
| Les solvants protiques préfèrent subir des réactions SN1. | Les solvants aprotiques préfèrent subir des réactions SN2. |
Résumé - Protique contre Aprotique Solvants
Les solvants sont des liquides capables de dissoudre les substances. Les solvants peuvent être trouvés sous deux formes principales en tant que solvants polaires et solvants non polaires. Les solvants polaires peuvent à nouveau être divisés en deux groupes sous forme de solvants protiques et de solvants aprotiques. La différence entre les solvants protique et aprotique est que les solvants protiques ont des atomes d'hydrogène dissociables tandis que les solvants aprotiques n'ont pas d'atome d'hydrogène dissociable.
Référence:
1.«Protique polaire? Aprotique polaire? Non polaire? Tout sur les solvants.»Master Organic Chemistry RSS. Disponible ici
2.«Solvant protique.”Wikipedia, Wikimedia Foundation, 17 décembre. 2017. Disponible ici
3.«Solvants aprotiques et protiques.”Scribd, scribd. Disponible ici


