Différence entre les halogénoalcanes secondaires primaires et tertiaires
Le différence clé entre les halogénoalcanes secondaires et tertiaires est la position de l'atome de carbone qui transporte l'atome halogène. Dans les halogénoalcanes primaires, l'atome de carbone, qui transporte l'atome halogène, est attaché à un seul groupe alkyle. Mais, dans les halogénoalcanes secondaires, cet atome de carbone est attaché à deux groupes alkyle. Alors que, dans les halogénoalcanes tertiaires, cet atome de carbone est attaché à trois groupes alkyle.
Les halogénoalcanes ou les haloalcanes sont des alcanes contenant des halogènes. Les halogènes sont des éléments chimiques du groupe 17 du tableau périodique. Il comprend le fluor (F), le chlore (CL), le brome (BR), l'iode (I) et l'astatine (AT). Il peut y avoir un ou plusieurs halogènes dans le même haloalkane. Il existe de nombreuses applications importantes des halogénoalcanes comme retardataires de flamme, des extincteurs, des réfrigérants, des propulseurs, etc. Cependant, de nombreux haloalcanes sont considérés comme des composés toxiques et des polluants.
CONTENU
1. Aperçu et différence clé
2. Quels sont les halogénoalkanes primaires
3. Que sont les halogénoalcanes secondaires
4. Que sont les halogénoalcanes tertiaires
5. Comparaison côte à côte - Halogénoalcanes secondaires primaires vs tertiaires dans la forme tabulaire
6. Résumé
Quels sont les halogénoalkanes primaires?
Les halogénoalcanes primaires sont des composés organiques qui ont un atome de carbone attaché à un groupe alkyle et un atome halogène. Par conséquent, la structure générale d'un halogénoalcanes primaire est r-ch2-X; R est un groupe alkyle tandis que x est un halogène. Nous pouvons les désigner comme 10 haloalcanes. Un exemple courant est un halothane, qui contient un groupe éthylique comme groupe R et un atome de chlore comme groupe X ou halogène. Cependant, les halogénures de méthyle sont une exception pour ces structures halogénoalcanes primaires car elles ont trois atomes d'hydrogène attachés à l'atome de carbone qui transporte l'atome halogène. Cela signifie qu'il n'y a pas de groupes alkyle attachés à ces composés. Mais ils sont considérés comme des haloalcanes primaires.
De plus, si nous considérons la réactivité des halogénoalcanes primaires, l'atome de carbone, qui est attaché à l'atome d'halogène, est un centre réactif car l'halogène est plus électronégatif que le carbone; Ainsi, il donne une charge positive partielle à l'atome de carbone en attirant les électrons de liaison vers lui-même. De plus, ces composés peuvent être attaqués par des réactifs nucléophiles qui recherchent des charges positives. Donc, cela conduit à une réaction de substitution nucléophile. Et, cette réaction a une barrière d'énergie d'activation élevée. C'est une réaction de type SN2, et nous l'appelons comme une réaction bimoléculaire.
Que sont les halogénoalcanes secondaires?
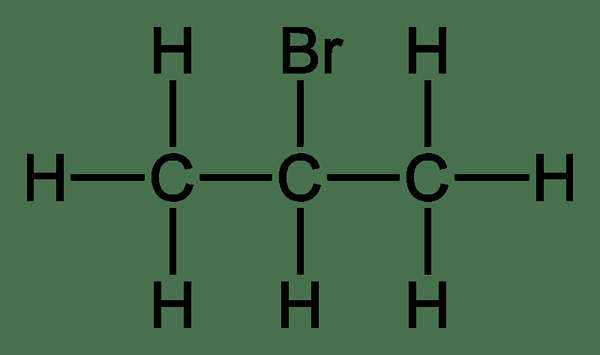
Les halogénoalcanes secondaires sont des composés organiques qui ont un atome de carbone attaché à deux groupes alkyle et un atome halogène. La structure générale d'un halogénoalcanes secondaire est r2-C (-H) -X. Ici, les deux groupes alkyles (groupe R) peuvent être des groupes similaires ou différents. Nous pouvons désigner ces composés comme 20 haloalcanes. De plus, les halogénoalcanes secondaires subissent des réactions de substitution nucléophile SN2. Par conséquent, ce sont des réactions bimoléculaires.

Figure 02: 2-bromopropane
La réactivité de l'haloalkane secondaire se situe entre les réactivités des halogénoalcanes primaires et tertiaires car la présence de deux groupe alkyle abaisse la charge positive sur l'atome de carbone car les groupes alkyle sont.
Que sont les halogénoalcanes tertiaires?
Les halogénoalcanes tertiaires sont des composés organiques qui ont un atome de carbone attaché à trois groupes alkyle (pas d'atomes d'hydrogène attachés directement à ce carbone) et un atome halogène. La structure générale d'un haloalkane tertiaire est R3-C-X, où trois groupes R (groupes alkyle) peuvent être les mêmes ou les groupes différents. Nous pouvons désigner ces composés comme 30 haloalcanes. De plus, ces composés subissent des réactions de substitution nucléophile SN1. Mais, ce mécanisme est différent des réactions de substitution nucléophile des halogénoalcanes primaires et secondaires.
L'atome de carbone qui transporte l'atome halogène a une charge positive très faible car il y a trois groupes d'électrons-tire. Par conséquent, il ne nécessite pas la formation d'intermédiaires à haute énergie, et le nucléophile peut attaquer directement l'ion carbonium dès qu'il se forme. C'est donc pourquoi nous l'appelons une réaction unimoléculaire.
Quelle est la différence entre les halogénoalcanes secondaires primaires et tertiaires?
Les halogénoalcanes ont trois types selon la structure; halogénoalcanes primaires, secondaires et tertiaires. Dans les halogénoalcanes primaires, l'atome de carbone qui porte l'atome d'halogène est attaché à un seul groupe alkyle, et dans les halogénoalcanes secondaires, cet atome de carbone est attaché à deux groupes alkyle, tandis que dans les halogénoalcanes tertiaires, cet atome de carbone est attaché à trois groupes alkyle. C'est donc la principale différence entre les halogénoalcanes secondaires primaires et tertiaires.
Suivant l'infographie résume la différence entre les halogénoalkanes secondaires primaires et tertiaires.
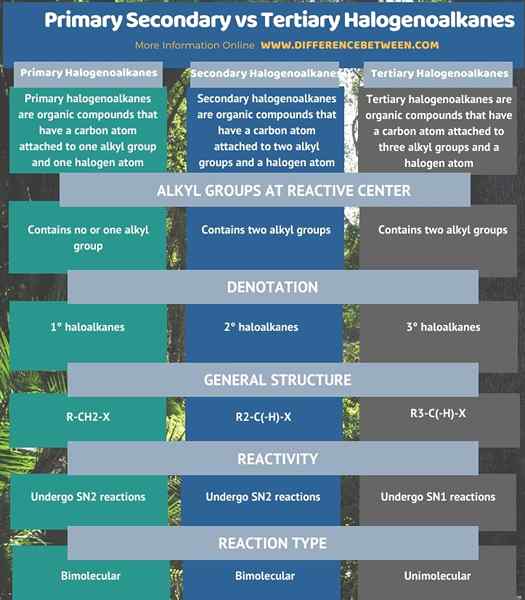
Résumé - secondaire primaire vs. Halogénoalkanes tertiaires
Il existe trois types d'halogénoalcanes en fonction de la structure; halogénoalcanes primaires, secondaires et tertiaires. La principale différence entre les halogénoalkanes secondaires primaires et tertiaires est que chez les halogénoalcanes primaires, l'atome de carbone, qui transporte l'atome halogène, est attaché à un seul groupe alkyle. Et, dans les halogénoalcanes secondaires, cet atome de carbone est attaché à deux groupes alkyle. En attendant, dans les halogénoalcanes tertiaires, cet atome de carbone est attaché à trois groupes alkyle.
Référence:
1. "dix.34 - halogénoalkanes." Chimie organique, Disponible ici.
Image gracieuseté:
1. «2-Bromopropane-2d-Flat» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia


