Différence entre les molécules polaires et dipolaires
Le différence clé entre les molécules polaires et dipolaires est que Les molécules polaires ont deux extrémités opposées avec des charges électriques opposées, tandis que les molécules dipolaires ont deux pôles.
Généralement, nous pouvons utiliser les termes polaires et dipolaires interchangeables parce que ces deux termes décrivent une seule molécule ayant deux extrémités opposées. Ces différentes extrémités surviennent en raison de la différence de distribution d'électrons dans toute la molécule.
CONTENU
1. Aperçu et différence clé
2. Que sont les molécules polaires
3. Que sont les molécules dipolaires
4. Comparaison côte à côte - molécules polaires vs dipolaires sous forme tabulaire
5. Résumé
Que sont les molécules polaires?
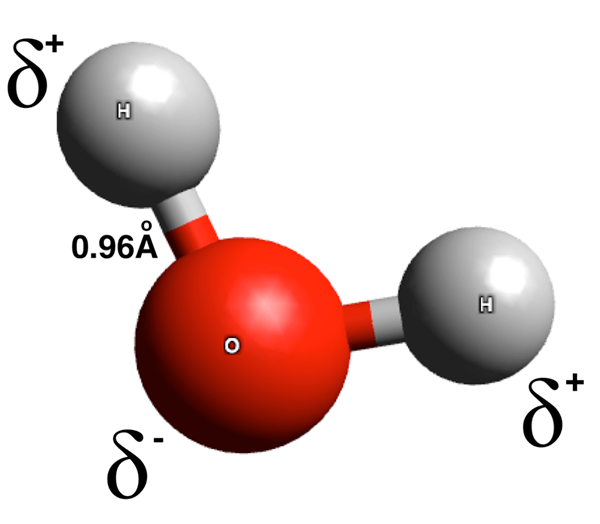
Les molécules polaires sont des espèces chimiques ayant des liaisons polaires. La somme des moments dipolaires de ces liaisons polaires n'est pas égale à zéro. Une obligation polaire a une fin chargée partiellement positive et une fin chargée partiellement négative. Ces charges électriques surviennent en raison des différences de distribution d'électrons à travers la liaison chimique. La différence de distribution d'électrons est le résultat de la différence dans la valeur de l'électronégativité des atomes dans la liaison chimique. Ici, l'atome plus électronégatif attire les électrons de la paire d'électrons de liaison vers lui-même, ce qui donne à cet atome une charge négative partielle. Par conséquent, l'autre atome de cette liaison obtient une charge positive partielle en raison du manque de densité électronique autour de lui, ce qui révèle la charge positive des protons dans les noyaux atomiques.

Figure 01: Séparation des charges dans une molécule d'eau
En outre, une molécule polaire peut se former lorsque la disposition spatiale de la molécule (géométrie) fait que les charges positives se rassemblent d'un côté de la molécule et des charges négatives du côté opposé. Certains exemples courants de molécules de peuplier comprennent l'eau, l'ammoniac, l'éthanol, le dioxyde de soufre et le sulfure d'hydrogène.
Que sont les molécules dipolaires?
Les molécules dipolaires sont des espèces chimiques qui ont deux pôles dans la même molécule. Un moment dipolaire se produit lorsqu'il y a une séparation des charges électriques en raison de la distribution inégale des électrons à travers la molécule. Des moments dipolaires se produisent en raison des différences de valeurs d'électronégativité des atomes dans la molécule. Contrairement aux composés polaires, les molécules dipolaires sont électriquement neutres (la charge électrique globale de la molécule est nulle). En effet, la séparation de charge de la molécule montre exactement la même valeur de charge électrique avec exactement l'orientation opposée, qui s'annule les uns les autres; Ainsi, il n'y a pas de frais nets.
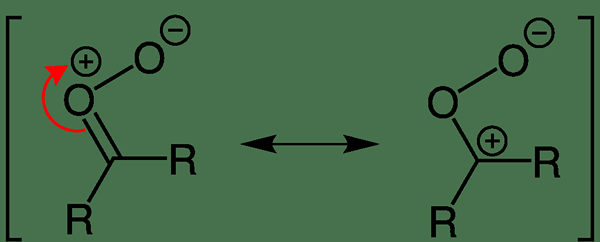
Figure 02: Délocalisation de la charge électrique dans l'oxyde de carbonyle
Dans la plupart des molécules dipolaires, les charges sont délocalisées dans toute la molécule. Certains exemples incluent l'oxyde de carbonyle, le diazométhane, le phosphonium ylide, etc.
Quelle est la différence entre les molécules polaires et dipolaires?
La principale différence entre les molécules polaires et dipolaires est que les molécules polaires ont deux extrémités opposées avec des charges électriques opposées, tandis que les molécules dipolaires ont deux pôles. Cependant, en termes généraux, nous pouvons utiliser les termes polaires et dipolaires interchangeables parce que ces deux termes décrivent une seule molécule ayant deux extrémités opposées.
En outre, une autre différence significative entre les molécules polaires et dipolaires est que les molécules polaires se forment lorsqu'il y a une séparation de charge tandis que les molécules dipolaires se forment en raison de la différence de valeurs d'électronégativité des atomes.
Vous trouverez ci-dessous une tabulation sommaire de la différence entre les molécules polaires et dipolaires.

Résumé - molécules polaires vs dipolaires
En bref, nous pouvons utiliser les termes polaires et polaires interchangeables parce que ces deux termes décrivent une seule molécule ayant deux extrémités opposées. La principale différence entre les molécules polaires et dipolaires est que les molécules polaires ont deux extrémités opposées avec des charges électriques opposées, tandis que les molécules dipolaires ont deux pôles.
Référence:
1. «13.3: Polarité des liaisons et moments dipolaires.”Chemistry LibreTexts, LibreTexts, 3 juin 2019, disponible ici.
2. «Composé dipolaire.»Wikipedia, Wikimedia Foundation, 13 juillet 2018, disponible ici.
Image gracieuseté:
1. «Modèle de balle et de bâton d'une molécule d'eau» par Soonlorpai - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Oxyde de carbonyle (Criegee Zwitterion)» par Wickey-NL - Propre travaux (CC0) via Commons Wikimedia


