Différence entre le phosphore et l'acide phosphorique

Différence clé - Phosphore vs acide phosphorique
Le phosphore et l'acide phosphorique sont deux formes d'acides contenant l'élément chimique phosphore (P). Les structures chimiques des deux molécules sont presque similaires mais les propriétés chimiques et physiques sont différentes les unes des autres. Le différence clé entre le phosphore et l'acide phosphorique est que L'acide phosphore (nom IUPAC: acide phosphonique) est diprotique tandis que l'acide phosphorique (nom IUPAC: Trihydroxidooxidophosphorus) est triprotique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acide phosphore
3. Qu'est-ce que l'acide phosphorique
4. Similitudes entre le phosphore et l'acide phosphorique
5. Comparaison côte à côte - phosphore vs acide phosphorique sous forme tabulaire
6. Résumé
Qu'est-ce que l'acide phosphore?
L'acide phosphoreux est un acide contenant du phosphore et la formule chimique est H3Pote3. Le nom IUPAC de l'acide phosphoreux est acide phosphonique. Bien que cette structure chimique contient trois atomes d'hydrogène, c'est un acide diprotique. Un acide diprotique est un acide capable de libérer deux ions hydrogène (protons) à un milieu aqueux. L'acide phosphoreux est également appelé acide orthophosphore.
La masse molaire d'acide phosphore est 81.99 g / mol. À température ambiante, c'est un solide blanc qui est déliquescent (absorber l'eau de l'air lorsqu'il est exposé et dissoudre). Le point de fusion de l'acide phosphoreux est de 73.6◦C et le point d'ébullition est de 200 ° C. À des températures au-dessus du point d'ébullition, les composés ont tendance à se décomposer. Lorsque l'on considère la structure chimique de l'acide phosphoreuse, il a un atome de phosphore car l'atome central s'est lié avec deux groupes -OH et un atome d'oxygène lié via une double liaison et un atome d'hydrogène lié via une seule liaison. Cette structure est connue sous le nom de structure pseudo-tétraédrique.
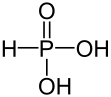
Figure 01: Structure chimique de l'acide phosphoreuse
L'acide phosphore est fabriqué par hydrolyse de l'anhydride de l'acide; P4O6.
P4O6 + 6 h2O → 4 H3Pote3
Mais dans les productions à l'échelle industrielle, le chlorure de phosphore (PCL3) est hydrolysé par la vapeur.
PCL3 + 3 h2O → H3Pote3 + 3 HCL
L'acide phosphore est utilisé comme agent réducteur dans l'analyse chimique. Cet acide se transforme facilement en acide phosphorique lorsqu'il est chauffé à environ 180 ° C. Les sels formés par l'acide phosphore sont appelés phosphites. L'application la plus courante de l'acide de phosphore est que; Il est utilisé dans la production de phosphite de plomb de base (un stabilisateur en PVC).
Qu'est-ce que l'acide phosphorique?
L'acide phosphorique est un phosphore contenant de l'acide ayant la formule chimique H3Pote4. Le nom IUPAC de ce composé est trihydroxidooxidophosphorus. C'est un acide triprotique car il peut libérer trois protons (ions hydrogène) dans un milieu aqueux.
La masse molaire de l'acide phosphorique est de 97.99 g / mol. L'acide phosphorique est disponible sous forme de solide blanc qui est déliquescent ou comme un liquide sirupeux qui a une viscosité élevée. Cependant, ce composé inodore. Le point de fusion de ce composé est 42.35◦C et le point d'ébullition est de 213 ° C, mais à des températures élevées, il se décompose.
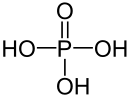
Figure 02: Structure chimique de l'acide phosphorique
La production d'acide phosphorique se fait via deux manières principales; processus humide et processus thermique. Le processus humide implique la production d'acide phosphorique à partir de fluorapatite. Il est connu sous le nom de phosphate roche et la composition chimique est 3CA3(Po4)2.Caf2. Cette roche phosphate est finement broyée pour augmenter la surface et réagit avec de l'acide sulfurique concentré qui donne de l'acide phosphorique et du gypse (Caso4.2h2O) comme produits.
Californie5(Po4)3F + 5H2DONC4 + 10h2O → 3H3Pote4+ 5caso4· 2h2O + HF
Le processus thermique de la production d'acide phosphorique comprend le phosphore élémentaire brûlant pour obtenir de l'acide phosphorique très pur. La brûlure du phosphore élémentaire donne du pentoxyde de phosphore (P2O5). Ce composé est ensuite hydraté pour produire de l'acide phosphorique.
P4 + 5o2→ 2p2O5
P2O5 + 3h2O → 2H3Pote4
Les principales applications de l'acide phosphorique sont en production d'engrais. L'acide phosphorique est utilisé pour produire trois types d'engrais au phosphore; Triple superphosphate, diammonium hydrogène phosphate et monoammonium dihydrogène phosphate.
Quelles sont les similitudes entre le phosphore et l'acide phosphorique?
- Le phosphore et l'acide phosphorique sont des acides contenant du phosphore.
- Le phosphore et l'acide phosphorique sont capables de libérer des protons lorsqu'ils sont en solutions aqueuses.
Quelle est la différence entre le phosphore et l'acide phosphorique?
Phosphore vs acide phosphorique | |
| L'acide phosphoreux est un acide contenant du phosphore et la formule chimique est H3Pote3. | L'acide phosphorique est un phosphore contenant de l'acide ayant la formule chimique H3Pote4. |
| Protons | |
| L'acide phosphore est diprotique | L'acide phosphorique est triprotique |
| Masse molaire | |
| La masse molaire d'acide phosphore est 81.99 g / mol. | La masse molaire de l'acide phosphorique est de 97.99 g / mol. |
| Nom IUPAC | |
| Le nom IUPAC de l'acide phosphoreux est de l'acide phosphonique. | Le nom IUPAC de l'acide phosphorique est le trihydroxidooxidophosphorus. |
| Point de fusion | |
| Le point de fusion de l'acide phosphoreux est de 73.6◦C et le point d'ébullition est de 200 ° C. | Le point de fusion de ce composé est 42.35◦C et le point d'ébullition est de 213 ° C, mais à des températures élevées, il se décompose. |
| Production | |
| L'acide phosphore est fabriqué par hydrolyse de l'anhydride de l'acide; P4O6 ou par chlorure de phosphore (PCL3) est l'hydrolyse par vapeur | L'acide phosphorique est fabriqué par processus humide ou processus thermique. |
Résumé - Phosphore vs acide phosphorique
L'acide phosphore et l'acide phosphorique sont des acides contenant du phosphore qui ont de nombreuses applications industrielles comme dans la production d'engrais. La différence entre le phosphore et l'acide phosphorique est que l'acide phosphore est diprotique alors que l'acide phosphorique est triprotique.
Référence:
1.«Acide phosphoreux.»Wikipedia, Wikimedia Foundation, 28 février. 2018. Disponible ici
2.Les éditeurs d'Encyclopædia Britannica. «Acide phosphoreux.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 23 février. 2018. Disponible ici
3.Lazonby, John. "Acide phosphorique."L'industrie chimique essentielle en ligne. Disponible ici
Image gracieuseté:
1.'Phosphonsäure - acide phosphoreux' par neurotiker - propre travail, (domaine public) via les communes wikimedia
2.«Phosphorsäure - acide phosphorique» par neurotiker - propre travail, (domaine public) via Commons Wikimedia


