Différence entre le pourcentage d'abondance et l'abondance relative
Différence clé - Pourcentage d'abondance vs abondance relative
Le pourcentage d'abondance et d'abondance relative sont les valeurs de pourcentage d'éléments chimiques qui représentent leur occurrence dans l'environnement. La principale différence entre le pourcentage d'abondance et l'abondance relative est que Le pourcentage d'abondance donne l'abondance d'isotopes tandis que l'abondance relative donne l'abondance d'éléments chimiques. Le pourcentage d'abondance peut être utilisé pour déterminer la masse atomique moyenne d'un certain élément chimique. L'abondance relative donne la survenue d'un certain élément chimique dans un environnement donné, je.e, sur terre.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le pourcentage d'abondance
3. Qu'est-ce que l'abondance relative
4. Similitudes entre le pourcentage d'abondance et l'abondance relative
5. Comparaison côte à côte - pourcentage d'abondance vs abondance relative sous forme tabulaire
6. Résumé
Qu'est-ce que le pourcentage d'abondance?
Le pourcentage d'abondance est le pourcentage de tous les isotopes naturels d'un élément. Les isotopes sont des atomes du même élément qui ont des nombres atomiques identiques mais des nombres de masse différents. Cela signifie que les isotopes sont des atomes ayant le même nombre de protons dans le noyau atomique, mais un nombre différent de neutrons.
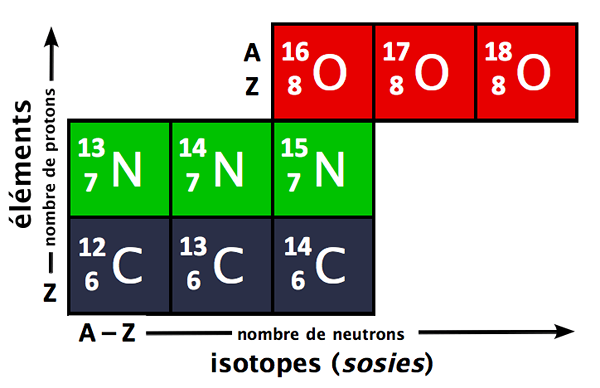
Figure 1: Les isotopes de différents éléments peuvent être utilisés pour trouver leurs masses atomiques moyennes
Les isotopes de chaque élément se produisent naturellement dans différents rapports. Le pourcentage d'abondance d'un isotope indique la probabilité de constater que l'isotope de nature car les éléments peuvent être trouvés comme un mélange d'isotopes. Le pourcentage d'abondance peut être utilisé pour trouver la masse atomique de l'élément. La masse atomique peut être trouvée en utilisant l'équation suivante.
Masse atomique moyenne = ∑ (masse d'isotope x pour cent abondance d'isotope)
Considérons un exemple pour comprendre cela. Les isotopes les plus stables et naturels de chlore sont CL-35 (masse = 34.969 et pourcentage d'abondance = 75.53%) et CL-37 (masse = 36.966 et pourcentage d'abondance = 24.47%). Alors,
La masse moyenne de chlore = ∑ (masse d'isotope x pour cent abondance d'isotope)
= ∑ (34.969 x 75.53/100) + (36.966 x 24.47/100)
= 26.412 AMU + 9.045 AMU
= 35.46 AMU.
Qu'est-ce que l'abondance relative?
L'abondance relative d'un élément est une mesure de la survenue d'un élément relatif à tous les autres éléments de l'environnement. Il existe trois façons de déterminer l'abondance relative d'un élément:
- Fraction de masse
- Fraction molaire
- Fraction volumique
La méthode de fraction de volume est la plus courante pour les éléments gazeux dans les mélanges de gaz, i.E, l'atmosphère de la Terre. Cependant, la plupart des expressions d'abondance relatives sont des fractions de masse.

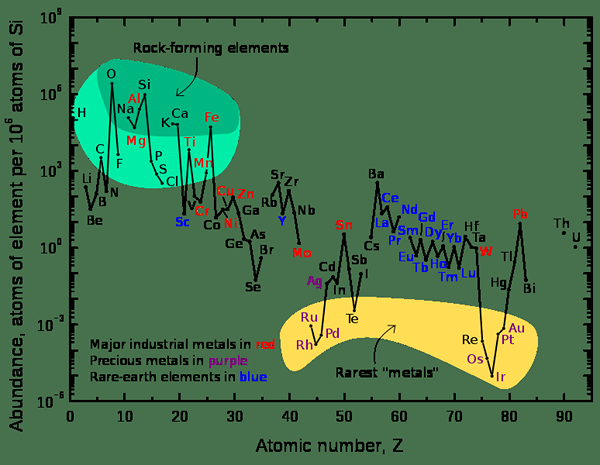
Figure 2: Un graphique montrant une abondance relative d'éléments sur la croûte supérieure de la Terre
Lorsque vous envisagez l'univers, les éléments chimiques les plus abondants sont l'hydrogène et l'hélium. Lorsque vous envisagez la Terre, l'élément le plus courant est le fer dont le pourcentage de masse est 32.1%. D'autres éléments sont l'oxygène (32.1%), en silicone (15.1%), magnésium (13.9%), soufre (2.9%) et d'autres éléments sont présents en pourcentages de trace.
Quelles sont les similitudes entre le pourcentage d'abondance et l'abondance relative?
- Le pourcentage d'abondance et d'abondance relative sont des valeurs de pourcentage.
- Le pourcentage d'abondance et d'abondance relative expriment les pourcentages de différents éléments chimiques.
Quelle est la différence entre le pourcentage d'abondance et l'abondance relative?
Pourcentage d'abondance vs abondance relative | |
| Le pourcentage d'abondance est le pourcentage de tous les isotopes naturels d'un élément. | L'abondance relative d'un élément est un pourcentage de la survenue d'un élément par rapport à tous les autres éléments de l'environnement. |
| Représentation | |
| Le pourcentage d'abondance donne l'abondance des isotopes. | L'abondance relative donne l'abondance d'éléments chimiques. |
Résumé - Pourcentage d'abondance vs abondance relative
Pourcentage d'abondance et d'abondance relative sont deux termes utilisés pour donner l'abondance des isotopes et des éléments chimiques. La principale différence entre le pourcentage d'abondance et l'abondance relative est que le pourcentage d'abondance donne l'abondance d'isotopes tandis que l'abondance relative donne l'abondance d'éléments chimiques.
Référence:
1. «Masse atomique moyenne.«Masse atomique moyenne, [protégée par e-mail], disponible ici.
2. «Abondance des éléments chimiques.»Wikipedia, Wikimedia Foundation, 25 février. 2018, disponible ici.
3. Simoes, chrétien. «Abondance des éléments chimiques.”Astrono, disponible ici.
Image gracieuseté:
1. «Isotope CNO» par Lucquissoy - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «Abondances élémentaires» par Gordon B. Haxel, Sara Boore et Susan Mayfield de l'USGS; Vectorisé par l'utilisateur: Michbich - (Domaine public) via Commons Wikimedia


