Différence entre synthèse asymétrique partielle et absolue
Le différence clé entre la synthèse asymétrique partielle et absolue est Cette synthèse asymétrique partielle est la création d'une chiralité moins favorable dans les molécules symétriques, tandis que la symétèse asymétrique absolue est la création d'une chiralité préférentielle dans un environnement symétrique à partir d'un réactif symétrique.
La synthèse asymétrique est un type de synthèse chimique où une réaction chimique a lieu, formant un ou plusieurs nouveaux éléments de chiralité dans une molécule de substrat. Nous pouvons trouver ce terme sous deux formes comme synthèse asymétrique partielle et synthèse asymétrique absolue. Cependant, le terme synthèse asymétrique partielle est rarement utilisé en chimie.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la synthèse asymétrique
3. Qu'est-ce que la synthèse asymétrique partielle
4. Qu'est-ce que la synthèse asymétrique absolue
5. Comparaison côte à côte - Synthèse asymétrique partielle vs Absolute sous forme tabulaire
6. Résumé
Qu'est-ce que la synthèse asymétrique?
Synthèse asymétrique, également connue sous le nom synthèse stéréosélective, est une réaction chimique ou une séquence de réaction où un ou plusieurs nouveaux éléments de formation de chiralité sont observables dans une molécule de substrat spécifique. Cela forme des produits stéréoisomériques (spécifiquement énantiomériques ou diastéréoisomères) qui sont inégaux en quantités. Cette méthode de synthèse est importante pour produire un énantiomère spécifique à partir de composés achiraux ou de mélanges racémiques. Il existe trois formes de synthèse asymétrique: synthèse absolue, synthèse asymétrique partielle et synthèse spécifique à l'énantio.
Ce type de réaction chimique est le résultat de l'influence qui provient d'une dissymétrie dans le système de réaction, e.g. La présence d'un centre de dissymétrie dans la molécule, la présence d'un solvant dissymétrique ou d'un catalyseur, présence d'une lumière polarisée circulaire, etc. Souvent, nous pouvons classer les réactions de synthèse asymétrique comme des réactions stéréosélectives. Ici, si l'un des produits se forme exclusivement, alors nous appelons la réaction une réaction stéréospécifique.
Qu'est-ce que la synthèse asymétrique partielle?
La synthèse asymétrique partielle est une réaction chimique qui implique la création d'une chiralité moins favorable dans les molécules symétriques. Ce terme est rarement utilisé en chimie car ce type de réaction chimique a moins de signification par rapport à la synthèse asymétrique absolue.

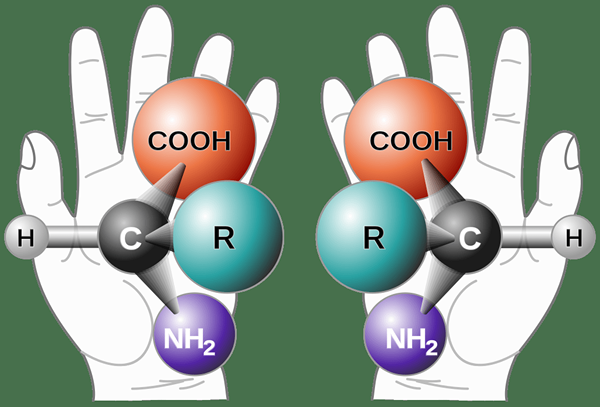
Figure 01: Chiralité dans un schéma simple
Par exemple, pour une synthèse asymétrique partielle, nous pouvons donner la réaction de l'oxyde de styrène optiquement actif avec un triéthyl alpha-phosphonopropionate, qui donne du 2-phényl-1-méthylcyclopropanecarboxylate, qui est chiral. Ce produit résultant a un centre asymétrique originaire d'oxyde de styrène.
Qu'est-ce que la synthèse asymétrique absolue?
La synthèse asymétrique absolue est une réaction chimique qui inclut la création d'une chiralité préférentielle dans un environnement symétrique à partir d'un réactif symétrique. Par exemple, si nous pouvons préparer le 2-hydroxypropanenitrile à partir du cyanure éthanal et hydrogène en l'absence d'autres réactifs chiraux, il donne un excès d'un éantiomère sur l'autre.
Quelle est la différence entre la synthèse asymétrique partielle et absolue?
Les termes la synthèse absolue et partielle sont principalement utilisées dans la synthèse asymétrique, où la chiralité est créée dans les molécules de substrat d'une réaction chimique. La principale différence entre la symétèse asymétrique partielle et absolue est que la symétèse asymétrique partielle est la création d'une chiralité moins favorable dans les molécules symétriques, tandis que la symétèse asymétrique absolue est la création d'une chiralité préférentielle dans un environnement symétrique à partir de réaction symétrique.
L'infographie ci-dessous répertorie les différences entre la synthèse asymétrique partielle et absolue sous forme tabulaire.

Résumé - Synthèse asymétrique partielle vs absolue
La synthèse asymétrique est un type de synthèse chimique où une réaction chimique a lieu en formant un ou plusieurs nouveaux éléments de la chiralité dans une molécule de substrat. Il existe deux formes comme synthèse asymétrique absolue et partielle. La principale différence entre la symétèse asymétrique partielle et absolue est que la synthèse asymétrique partielle est la création d'une chiralité moins favorable dans les molécules symétriques tandis que la symétèse asymétrique absolue est la création d'une chiralité préférentielle dans un environnement symétrique à partir de réactive symétrique.
Référence:
1. «Synthèse asymétrique.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., Disponible ici.
2. «19.10: synthèse asymétrique.”Chemistry LibreTexts, LibreTexts, 5 mars. 2021, disponible ici.
3. «Synthèse asymétrique.”Slideshare, disponible ici.
Image gracieuseté:
1. «Chiralité avec les mains» par Original: Unknownvector: - πϵρήλιο - Chiralité avec les mains.JPG (domaine public) via Commons Wikimedia


