Différence entre l'énergie libre et l'énergie d'activation
Le différence clé entre l'énergie libre et l'énergie d'activation est que L'énergie libre est la quantité de L'énergie disponible pour un système thermodynamique pour effectuer des travaux thermodynamiques, tandis que l'énergie d'activation d'une réaction chimique est la barrière d'énergie qui doit être surmontée afin d'obtenir des produits à partir de la réaction.
L'énergie libre et l'énergie d'activation sont deux termes différents qui ont également des applications différentes. Le terme énergie libre est utilisé en ce qui concerne les systèmes thermodynamiques en chimie physique, tandis que le terme énergie d'activation est principalement utilisé en ce qui concerne les réactions chimiques en biochimie.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'énergie libre
3. Qu'est-ce que l'énergie d'activation
4. Comparaison côte à côte - énergie libre vs énergie d'activation sous forme tabulaire
5. Résumé
Qu'est-ce que l'énergie libre?
L'énergie libre est la quantité d'énergie disponible pour un système thermodynamique pour effectuer un travail thermodynamique. L'énergie libre a les dimensions de l'énergie. La valeur de l'énergie libre d'un système thermodynamique est déterminée par l'état actuel du système, et non par son histoire. Il existe deux principaux types d'énergie libre souvent discuté dans la thermodynamique: Helmholtz Free Energy et Gibbs Free Energy.
L'énergie libre de Helmholtz est l'énergie qui est disponible dans un système thermodynamique fermé pour effectuer des travaux thermodynamiques à température constante et à volume. Par conséquent, la valeur négative de l'énergie Helmholtz indique le travail maximum qu'un système thermodynamique peut effectuer en maintenant son volume constant. Afin de maintenir le volume constant, une partie du travail thermodynamique total est effectuée comme un travail limite (pour conserver la limite du système telle qu'elle est).
L'énergie libre de Gibbs est l'énergie disponible dans un système fermé et thermodynamique pour effectuer des travaux thermodynamiques à température et à la pression constantes. Le volume du système peut varier. L'énergie libre est indiquée par g.
Qu'est-ce que l'énergie d'activation?
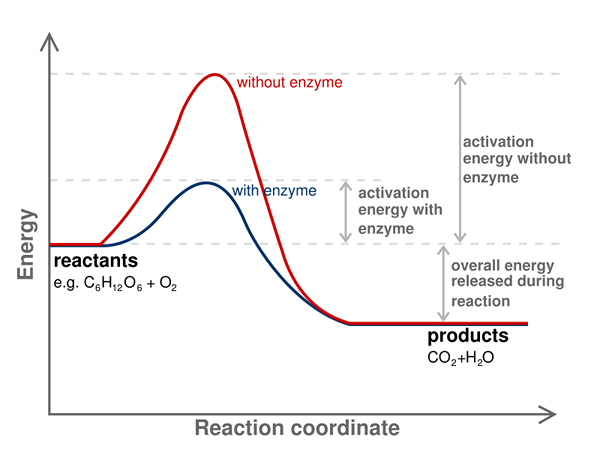
L'énergie d'activation d'une réaction chimique est la barrière d'énergie qui doit être surmontée afin d'obtenir des produits à partir de la réaction. En d'autres termes, c'est l'énergie minimale requise pour qu'un réactif se transforme en produit. Il est toujours nécessaire de fournir une énergie d'activation afin de commencer une réaction chimique.
Nous désignons l'énergie d'activation comme eun ou ae; Nous le mesurons par l'unité KJ / MOL. De plus, l'énergie d'activation est considérée comme l'énergie minimale nécessaire pour former l'intermédiaire avec l'énergie potentielle la plus élevée dans une réaction chimique. Certaines réactions chimiques ont une progression lente et se déroulent via deux pas ou plus. Ici, des intermédiaires sont formés puis réorganisés pour former le produit final. Ainsi, l'énergie nécessaire pour démarrer cette réaction est l'énergie nécessaire pour former l'intermédiaire avec l'énergie potentielle la plus élevée.

De plus, les catalyseurs peuvent réduire l'énergie d'activation. Par conséquent, les catalyseurs sont souvent utilisés pour surmonter la barrière d'énergie et laisser la réaction chimique progresser. Les enzymes sont des catalyseurs biologiques qui peuvent diminuer l'énergie d'activation de la réaction dans les tissus.
Quelle est la différence entre l'énergie libre et l'énergie d'activation?
L'énergie libre et l'énergie d'activation sont deux termes différents qui ont également des applications différentes. La principale différence entre l'énergie libre et l'énergie d'activation est que l'énergie libre est la quantité d'énergie disponible pour un système thermodynamique pour effectuer des travaux thermodynamiques, tandis que l'énergie d'activation d'une réaction chimique est la barrière d'énergie qui doit être surmontée afin d'obtenir des produits à partir de produits la réaction.
Vous trouverez ci-dessous le résumé de la différence entre l'énergie libre et l'énergie d'activation sous forme tabulaire.
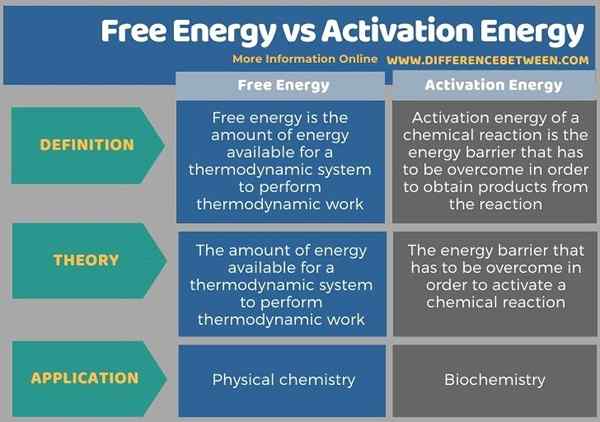
Résumé - Énergie libre vs énergie d'activation
L'énergie libre et l'énergie d'activation sont deux termes différents qui ont des applications différentes. La principale différence entre l'énergie libre et l'énergie d'activation est que l'énergie libre est la quantité d'énergie disponible pour un système thermodynamique pour effectuer des travaux thermodynamiques, tandis que l'énergie d'activation d'une réaction chimique est la barrière d'énergie qui doit être surmontée afin d'obtenir des produits à partir de produits la réaction.
Référence:
1. Helmenstine, Anne Marie. «Définition de l'énergie d'activation en chimie."Thoughtco, août. 27, 2020, disponible ici.
Image gracieuseté:
1. «Activation2 Mise à jour» à l'origine téléchargé par Jerry Crimson Mann, vectorisé par tutmosis, corrigé par fvasconcellos - EN: Image: Activation2.png (cc by-sa 3.0) via Commons Wikimedia


