Différence entre le numéro d'oxydation et la charge
Le différence clé entre le numéro d'oxydation et la charge est que Nous pouvons déterminer le nombre d'oxydation d'un atome compte tenu du nombre d'électrons qui est retiré ou gagné par cet atome alors que la charge est déterminée en considérant le nombre total d'électrons et de protons dans l'atome.
Différents éléments du tableau périodique présentent différentes caractéristiques chimiques et physiques. Et quand ils se joignent pour former des molécules, différents éléments se joignent à d'autres éléments dans différentes proportions. Parmi un grand nombre de variations entre les éléments, les paramètres les plus simples et les plus importants sont leur numéro de charge et d'oxydation. La charge et le nombre d'oxydation d'un élément aident à identifier, auquel le groupe appartient à cet élément au tableau périodique. Plus important encore, il aide à décrire la capacité de l'élément à former d'autres molécules et composés de coordination, et ainsi, aide à identifier leurs formules empiriques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le numéro d'oxydation
3. Qu'est-ce que les frais
4. Comparaison côte à côte - Numéro d'oxydation vs charge sous forme tabulaire
5. Résumé
Qu'est-ce que le numéro d'oxydation?
Le numéro d'oxydation est une caractéristique de l'atome central d'un composé de coordination. C'est la charge de l'atome central d'un composé de coordination lorsque toutes les obligations autour de cet atome sont des obligations ioniques. Par conséquent, parfois la charge et le nombre d'oxydation sont similaires, mais parfois c'est différent. Par exemple, les éléments de blocs S simple et de bloc P ont le même numéro d'oxydation que leur charge. De plus, les ions polyatomiques ont le même numéro d'oxydation que la charge. Cependant, le même élément chimique peut avoir des nombres d'oxydation différents, selon les autres atomes qui l'entourent. Dans un élément libre, le numéro d'oxydation est toujours nul. De plus, les ions de métal de transition (bloc D) et les éléments ont des nombres d'oxydation différents.
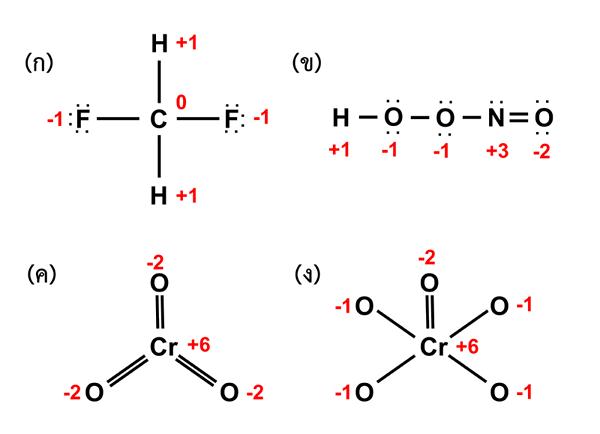
Figure 01: Détermination des nombres d'oxydation de différents éléments dans les composés
Lorsque vous envisagez un composé de coordination, l'atome métallique central doit toujours avoir des orbitales vides auxquelles les ligands donnent leurs paires d'électrons solitaires et forment des liaisons ioniques. De plus, nous pouvons désigner le numéro d'oxydation de l'atome métallique central avec des numéros romains à l'intérieur des supports. Par exemple, si le nombre d'oxydation de «m» métallique est 3, alors nous l'écrivons comme m (iii).
Qu'est-ce que les frais?
La charge de tout atome est nul. Lorsque les atomes retirent ou gagnent des électrons, ils obtiennent une charge électrique. C'est parce que les électrons sont des particules subatomiques chargées négativement tandis que les protons sont chargés positivement. Les atomes éliminent ou gagnent des électrons pour remplir leur coquille de valence selon la règle des octets.
Dans un atome, le nombre de protons et d'électrons est égal. Étant donné que les protons ont une charge positive et que les électrons ont une charge négative, lorsque les électrons de la coquille de valence retirent, l'atome forme un ion chargé positivement, car alors le nombre de protons positifs est plus élevé que le nombre d'électrons dans cet ion.
Détermination de l'accusation
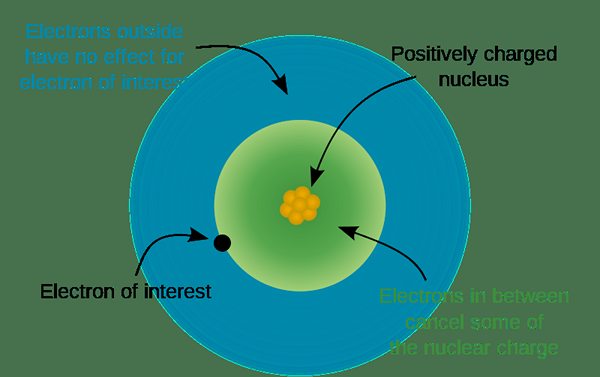
De plus, lorsqu'un atome est plus électronégatif, il peut attirer des électrons d'autres atomes vers lui-même. Là, ils gagnent plus d'électrons que le nombre de protons réside dans leur noyau. Ainsi, les atomes deviennent des ions négatifs. De plus, le nombre d'électrons donnés ou abstraits diffère de l'atome à l'atome. Nous pouvons prédire cela à partir de la position de l'élément dans le tableau périodique. Habituellement, les mêmes atomes de groupe formeront les mêmes ions chargés, car ils ont le même nombre d'électrons de valence.

Figure 02: Structure d'un atome pour déterminer la charge
Le numéro de groupe montre également le nombre d'électrons de valence; Par conséquent, nous pouvons déterminer la charge des ions formés par les atomes de ce groupe. Par exemple, les éléments du groupe un forment des ions monovalents avec une charge électrique +1. Les éléments du groupe deux forment des ions divalents chargés positivement. Les atomes du groupe trois et du groupe quatre forment +3 et +4 ions chargés en conséquence. Du groupe cinq au groupe sept, les atomes fabriquent des ions chargés négativement, car il est plus facile de remplir leurs électrons de valence en obtenant simplement 2 ou 3 électrons plutôt que d'émettre cinq, six ou sept électrons. Par conséquent, les éléments du groupe cinq fabriquent -3 des ions chargés, tandis que les éléments du groupe 6 fabriquent -2 les ions et les éléments du groupe 7 font -1 ions. À part ces ions simplement chargés, il existe également des ions complexes avec des charges comme NH4+ et Cie32-etc.
Quelle est la différence entre le numéro d'oxydation et la charge?
Le numéro d'oxydation et la charge sont deux termes connexes en chimie. Cependant, il existe certaines différences entre le nombre d'oxydation et la charge. La principale différence entre le nombre d'oxydation et la charge est que nous pouvons déterminer le nombre d'oxydation d'un atome compte tenu du nombre d'électrons qui est retiré ou gagné par cet atome alors que la charge est déterminée en considérant le nombre total d'électrons et de protons dans l'atome.
De plus, il peut y avoir plusieurs nombres d'oxydation pour le même élément chimique en fonction des atomes qui l'entourent tandis que la charge d'atome est variable en fonction du nombre d'électrons et de protons dans l'atome. Par conséquent, c'est une autre différence importante entre le nombre d'oxydation et la charge.

Résumé - Numéro d'oxydation vs charge
Le numéro de charge et d'oxydation est deux termes connexes. La principale différence entre le nombre d'oxydation et la charge est que nous pouvons déterminer le nombre d'oxydation d'un atome en tenant compte du nombre d'électrons qui sont supprimés ou gagnés par cet atome alors que la charge est déterminée en tenant compte du nombre total d'électrons et de protons dans l'atome.
Référence:
1. «Numéro d'oxydation.»Métaux de transition. Disponible ici
2. LibreTexts. «L'atome.”Chemistry LibreTexts, National Science Foundation, 26 novembre. 2018. Disponible ici
Image gracieuseté:
1.«Affectations d'état d'oxydation» par Saranphong Yimklan - Propre travaux, (domaine public) via Commons Wikimedia
2.«Charge nucléaire efficace» par son propre travail - charge nucléaire efficace.GIF, (domaine public) via Commons Wikimedia


